摘要:27].聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂.广泛用于水的处理.用铁的氧化物为原料来制取聚合硫酸铁.为控制水解时Fe3+的浓度.防止生成氢氧化铁沉淀.原料中的Fe3+必须先还原为Fe3+.实验步骤如下: (1)用98%的硫酸配制28%的硫酸.所需的玻璃仪器除量筒外.还有 . 烧杯 (c) 烧瓶 (2)步骤II取样分析溶液中的Fe2+ .Fe3+ 的含量.目的是 . (a) 控制溶液中Fe2+与Fe3+ 含量比 (b) 确定下一步还原所需铁的量 (c) 确定氧化Fe2+所需NaClO3的量 (d) 确保铁的氧化物酸溶完全 (3)用NaClO3氧化时反应方程式如下: 6FeSO4+NaClO3+3H2SO4→3Fe2(SO4)3+NaCl+3H2O 若改用HNO3氧化.则反应方程式如下: 6FeSO4+2HNO3+3H2SO4→3Fe2(SO4)3+NO↑+4H2O 已知1mol HNO3价格0.16元.1mol NaClO3价格0.45元.评价用HNO3代替NaClO3作氧化剂的利弊.利是 .弊是 . 聚合硫酸铁溶液中SO42¯与Fe3+ 物质的量之比不是3︰2.根据下列供选择的试剂和基本操作.测定聚合硫酸铁产品溶液中SO42¯与Fe3+物质的量之比 . (4)测定时所需的试剂 . FeSO4 (c) BaCl2 (d) NaClO3 (5)需要测定和的质量 . (6)选出测定过程中所需的基本操作. 过滤.洗涤 (c) 蒸发.结晶 烘干或灼烧
网址:http://m.1010jiajiao.com/timu3_id_35627[举报]
绿矾是一种重要的化工原料.
【问题1】绿矾晶体(FeSO4?7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质.为探究绿矾样品的变质情况,化学兴趣小组的同学设计了下列实验方案.可供选择的试剂:KSCN溶液、酸性KMnO4溶液、Cl2水、NaOH溶液、BaCl2溶液请参与完成方案设计.
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液.
方案1:取少量溶液,加入几滴 试剂,如果观察到的现象是 ;实验结论:证明绿矾样品没有被氧化.
方案2:取少量溶液,加入几滴 试剂,如果观察到的现象是 .
实验结论:证明绿矾样品完全被氧化.
使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式 .
【问题2】以绿矾为原料可以制取聚合硫酸铁(SPFS).聚合硫酸铁是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用.其组成可表示成Fex(OH)y(SO4)z?nH2O(其中Fe为+3价).工业上常用的一种制备流程为:

取7.507g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485g,向上述滤液中加入NH3?H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.800g.通过计算确定该固体聚合硫酸铁样品的化学式为 .(写出计算过程)
查看习题详情和答案>>
【问题1】绿矾晶体(FeSO4?7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质.为探究绿矾样品的变质情况,化学兴趣小组的同学设计了下列实验方案.可供选择的试剂:KSCN溶液、酸性KMnO4溶液、Cl2水、NaOH溶液、BaCl2溶液请参与完成方案设计.
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液.
方案1:取少量溶液,加入几滴
方案2:取少量溶液,加入几滴
实验结论:证明绿矾样品完全被氧化.
使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式
【问题2】以绿矾为原料可以制取聚合硫酸铁(SPFS).聚合硫酸铁是一种重要的无机高分子絮凝剂,极易溶于水,作为工业和生活污水处理等领域具有重要的应用.其组成可表示成Fex(OH)y(SO4)z?nH2O(其中Fe为+3价).工业上常用的一种制备流程为:

取7.507g某固体聚合硫酸铁溶解于水,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.485g,向上述滤液中加入NH3?H2O,调节溶液pH=6,经过滤、洗涤、干燥得Fe2O3固体2.800g.通过计算确定该固体聚合硫酸铁样品的化学式为
硫酸亚铁是一种重要的食品和饲料添加剂,某课外兴趣小组在实验室用废铁屑与稀硫酸在加热条件下制取FeSO4?X H2O,并测定该晶体中结晶水含量.请回答下列问题:
(1)铁屑表面少量的铁锈(主要成分为Fe2O3?a H2O )对制取硫酸亚铁有无影响
(2)FeSO4在不同温度下溶解度如下表所示:
由于铁屑中含有C、Si等杂质,为了使FeSO4 溶液的浓度增大,便于反应后分离溶液和残渣.该小组实验时采取了水浴加热和趁热过滤的方法,这样做的主要目的是为了防止
(A)冷却 (B)蒸发
(C)结晶 (D)洗涤 (E)过滤
(3)以下是测定FeSO4?xH2O中结晶水含量的实验流程.(称量仪器为电子天平)
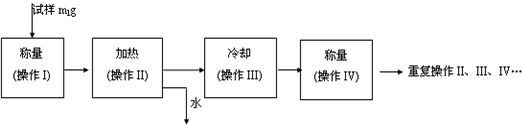
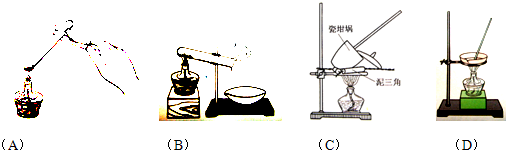
①其加热装置正确的是
②重复操作II、III、IV,直到连续两次称量结果相差不超过
③操作III必须要在
(4)以下结晶水含量测定操作正确的是
A、加热时,晶体溅出坩埚,再加些FeSO4?xH2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现
查看习题详情和答案>>
(1)铁屑表面少量的铁锈(主要成分为Fe2O3?a H2O )对制取硫酸亚铁有无影响
无
无
(填“有”或“无”.其原因是生成的少量Fe3+与铁屑反应转化为Fe2+;
生成的少量Fe3+与铁屑反应转化为Fe2+;
,该步实验的关键是保证铁屑
铁屑
过量(填“硫酸”或“铁屑”);(2)FeSO4在不同温度下溶解度如下表所示:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
硫酸亚铁晶体析出
硫酸亚铁晶体析出
.你认为实验时的水浴温度最好控制在60
60
℃左右.从滤液中获得FeSO4?xH2O,下列操作中不需要的是B
B
;(A)冷却 (B)蒸发
(C)结晶 (D)洗涤 (E)过滤
(3)以下是测定FeSO4?xH2O中结晶水含量的实验流程.(称量仪器为电子天平)

①其加热装置正确的是
C
C

②重复操作II、III、IV,直到连续两次称量结果相差不超过
0.001
0.001
g;③操作III必须要在
干燥器
干燥器
中(填仪器名称)进行.(4)以下结晶水含量测定操作正确的是
C
C
;A、加热时,晶体溅出坩埚,再加些FeSO4?xH2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现
偏大
偏大
;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气偏小
偏小
.铁是一种历史悠久、应用最广泛、用量最大的金属,铁盐也有广泛的应用.
(1)取少量纯铁粉与足量的稀硫酸反应,在不影响产生氢气总量的情况下,若要加快反应速率,可行的方法有(填序号)
①加热 ②滴加少量浓硝酸 ③滴加少量硫酸铜溶液
(2)FeCl3的水溶液呈
实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以
把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(3)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置.可以观察到的现象是
查看习题详情和答案>>
(1)取少量纯铁粉与足量的稀硫酸反应,在不影响产生氢气总量的情况下,若要加快反应速率,可行的方法有(填序号)
①
①
.①加热 ②滴加少量浓硝酸 ③滴加少量硫酸铜溶液
(2)FeCl3的水溶液呈
酸
酸
(填“酸”、“中”或“碱”)性,常温时的pH<
<
7(填“>”、“=”或“<”),原因是(用离子方程式表示):Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
.实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以
抑制
抑制
(填“促进”或“抑制”)其水解.把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是
Fe2O3
Fe2O3
.(3)向盛有1mL0.1mol/LMgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置.可以观察到的现象是
白色沉淀转化为红褐色的沉淀
白色沉淀转化为红褐色的沉淀
,产生该现象的原因是(用离子方程式表示)3Mg(OH)2+2Fe3+═3Mg2++2Fe(OH)3
3Mg(OH)2+2Fe3+═3Mg2++2Fe(OH)3
.按要求完成下列问题:
(1)工业上通常把氯气通入石灰乳中来制漂白粉,该反应的化学方程式为
(2)现有:①石灰水; ②水玻璃; ③氯化钡溶液.在上面四种溶液分别通入过量的CO2后,能产生白色浑浊有
(3)硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,而硫酸铁则无这种药效.当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是
查看习题详情和答案>>
(1)工业上通常把氯气通入石灰乳中来制漂白粉,该反应的化学方程式为
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
,还原剂是Cl2
Cl2
.(2)现有:①石灰水; ②水玻璃; ③氯化钡溶液.在上面四种溶液分别通入过量的CO2后,能产生白色浑浊有
②
②
(填序号);所发生反应离子方程式为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
.(3)硫酸亚铁是一种可用于治疗缺铁性贫血的药剂,而硫酸铁则无这种药效.当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是
保护FeSO4不被空气中的氧气氧化成Fe2(SO4)3
保护FeSO4不被空气中的氧气氧化成Fe2(SO4)3
.如果药片已经失效,应如何检验?简述主要步骤:取少量研碎的药片放入烧杯中,加适量的水溶解,然后滴加几滴KSCN溶液
然后滴加几滴KSCN溶液
;现象和结论反应后溶液显血红色,则表明该药片已经失效
反应后溶液显血红色,则表明该药片已经失效
.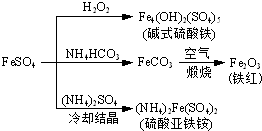 (2013?江苏三模)硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( )
(2013?江苏三模)硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示).下列说法错误的是( )