摘要:已知X.Y.Z.W四钟元素是元素周期表中连续三个不同短周期的元素.且原子序数依次增大.X.W同主族.Y.Z为同周期的相邻元素.W原子的质子数等于Y.Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.试推断: (1)X.Y.Z.W四种元素的符号: X .Y .Z .W (2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为 . (3)由X.Y.Z所形成的离子化合物是 .它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是 .
网址:http://m.1010jiajiao.com/timu3_id_356083[举报]
已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键,试推断:
(1)X、Z两种元素的元素符号:X
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为
 ,它的共价键属于
,它的共价键属于
 .
.
(3)由X、Y、Z所形成的常见离子化合物是
 ,两种化合物的浓溶液混合共热的离子反应方程式为
,两种化合物的浓溶液混合共热的离子反应方程式为
(4)X与W形成的化合物的电子式为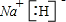
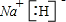 ,将该化合物溶于水,发生反应的化学方程式为
,将该化合物溶于水,发生反应的化学方程式为
查看习题详情和答案>>
(1)X、Z两种元素的元素符号:X
H
H
、ZO
O
.(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为


极性
极性
(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为

(3)由X、Y、Z所形成的常见离子化合物是
NH4NO3
NH4NO3
(写化学式),由X、Z、W三元素形成的离子化合物的电子式为

NH4++OH-?NH3↑+H2O
NH4++OH-?NH3↑+H2O
.(4)X与W形成的化合物的电子式为
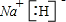
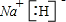
NaH+H2O═NaOH+H2↑
NaH+H2O═NaOH+H2↑
,其中水做氧化
氧化
剂(填“氧化”或“还原”).(2008?驻马店二模)已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.试推断:
(1)X的元素符号为
(2)由以上元素中的两种元素组成的物质中有一种能与H2O反应释放出空气中的主要成分之一的气体,则该物质的电子式为
 ,化学键类型为
,化学键类型为
(3)由X、Y、Z所形成的常见离子化合物的化学式为
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是
查看习题详情和答案>>
(1)X的元素符号为
H
H
,元素Z在周期表中的位置为第二周期ⅥA族
第二周期ⅥA族
.(2)由以上元素中的两种元素组成的物质中有一种能与H2O反应释放出空气中的主要成分之一的气体,则该物质的电子式为


离子键、共价键
离子键、共价键
.(3)由X、Y、Z所形成的常见离子化合物的化学式为
NH4NO3
NH4NO3
,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
| ||
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是
原子晶体
原子晶体
. 已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)
已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)(1)(XY)2分子中所有原子最外层都满足8电子,请写出其结构式:
(2)已知乙炔在一定条件下可以三聚生成苯:
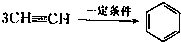 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:(3)三聚氰胺遇强簸或强碱水溶液发生水解,氨基逐步被羟基取代生成三聚氰酸.三聚氰胺由于含氮量高而被一些奶粉厂家非法掺人奶粉中以提高其产品的含氮量(俗称蛋白精),经研究表明三聚氰胺和三聚氰酸在肾细胞中结合沉积从而形成肾结石,堵塞肾小管,最终造成肾衰竭,严重则危及生命.试写出三聚氰胺生成三聚氰酸的化学方程式:
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将XZ2转化成有机物实现碳循环.如:2XZ2(g)+2W2Z(l)═X2W4(g)+3Z2(g)△H=+1411.0kJ/mol;2XZ2(g)+3W2Z(l)═X2W5ZW(l)+3Z2(g)△H=+1366.8kJ/mol则由X2W4水化制X2W5ZW反应的热化学方程式为
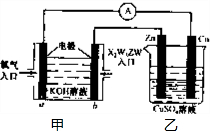
(5)利用X2W5ZW燃料电池设计如图所示的装置:
①则该装置中Cu极为
②写出b极的电极反应式为
③当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为
已知X、Y、Z、W四种元素分布在元素周期表中的三个不同短周期元素里,且原子序数依次增大,X、W同主族,Y、Z为同周期的相邻元素,W原子的质子数等于Y、Z原子最外层电子数之和,Z原子最外层电子数是次外层电子数的3倍.试推断:
(1)写出X、Y的元素符号:X
(2)W+和Z2-的核外电子排布相同,两种微粒半径大小关系为
(3)由X、Y、Z所形成的离子化合物的化学式是
(4)已知拆开1mol X-X键、1mol Y≡Y、1mol Y-X键分别需要吸收的能量为436kJ、946kJ、391kJ.则由X2和Y2反应生成1mol YX3,需要
查看习题详情和答案>>
(1)写出X、Y的元素符号:X
H
H
、YN
N
.(2)W+和Z2-的核外电子排布相同,两种微粒半径大小关系为
O2->Na+
O2->Na+
.(3)由X、Y、Z所形成的离子化合物的化学式是
NH4NO3
NH4NO3
,它与W的最高价氧化物的水化物的溶液反应时的离子方程式是NH4++OH-=NH3?H2O
NH4++OH-=NH3?H2O
.(4)已知拆开1mol X-X键、1mol Y≡Y、1mol Y-X键分别需要吸收的能量为436kJ、946kJ、391kJ.则由X2和Y2反应生成1mol YX3,需要
放出
放出
(填“放出”或“吸收”)的热量是46
46
kJ.已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大.X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y与X形成的分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z两种元素的元素符号:X
(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为
 ,它的共价键属于
,它的共价键属于
 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为
 .
.
(3)由X、Y、Z所形成的常见离子化合物是
X与W形成的化合物与水反应时,水作的是
(4)用电子式表示W与Z形成W2Z化合物的过程:
 .
.
(5)Q与Z同主族,位于第四周期,其原子序数为
查看习题详情和答案>>
(1)X、Z两种元素的元素符号:X
H
H
、ZO
O
.(2)由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为


极性
极性
(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为



(3)由X、Y、Z所形成的常见离子化合物是
NH4NO3
NH4NO3
(写化学式),该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为:NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
.
| ||
X与W形成的化合物与水反应时,水作的是
氧化剂
氧化剂
(填“氧化剂”或“还原剂”)(4)用电子式表示W与Z形成W2Z化合物的过程:


(5)Q与Z同主族,位于第四周期,其原子序数为
34
34
.