网址:http://m.1010jiajiao.com/timu3_id_356014[举报]
(13分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去):
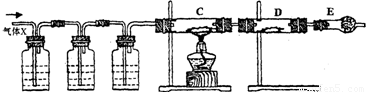
A KMnO4溶液 B
试回答:
(1)上述反应中生成二氧化硫的化学方程式为 ______________ ;
(2)乙同学认为还可能产生氢气的化学方程式是 ;
(3)丙同学在安装好装置后,必不可少的一步操作是: ;
(4)A中加入的试剂可能是 ,作用是_____ ;
B中加入的试剂可能是 ,作用是 ___________ ;
E中加入的试剂可能是 ,作用是 ___________ 。
(5)可以证明气体X中含有氢气的实验现象是:
C中:_____________________;D中:_____________________________
查看习题详情和答案>>
(13分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去):
A KMnO4溶液 B
试回答:
(1)上述反应中生成二氧化硫的化学方程式为 ______________ ;
(2)乙同学认为还可能产生氢气的化学方程式是 ;
(3)丙同学在安装好装置后,必不可少的一步操作是: ;
(4)A中加入的试剂可能是 ,作用是_____ ;
B中加入的试剂可能是 ,作用是 ___________ ;
E中加入的试剂可能是 ,作用是 ___________ 。
(5)可以证明气体X中含有氢气的实验现象是:
C中:_____________________;D中:_____________________________
查看习题详情和答案>>
(13分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去):
A KMnO4溶液 B
试回答:
(1)上述反应中生成二氧化硫的化学方程式为 ______________ ;
(2)乙同学认为还可能产生氢气的化学方程式是 ;
(3)丙同学在安装好装置后,必不可少的一步操作是: ;
(4)A中加入的试剂可能是 ,作用是_____ ;
B中加入的试剂可能是 ,作用是 ___________ ;
E中加入的试剂可能是 ,作用是 ___________ 。
(5)可以证明气体X中含有氢气的实验现象是:
C中:_____________________;D中:_____________________________。
查看习题详情和答案>>
(13分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验时,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示的实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去):
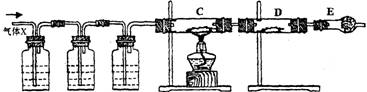
A KMnO4溶液 B
试回答:
(1)上述反应中生成二氧化硫的化学方程式为 ______________ ;
(2)乙同学认为还可能产生氢气的化学方程式是 ;
(3)丙同学在安装好装置后,必不可少的一步操作是: ;
(4)A中加入的试剂可能是 ,作用是_____ ;
B中加入的试剂可能是 ,作用是 ___________ ;
E中加入的试剂可能是 ,作用是 ___________ 。
(5)可以证明气体X中含有氢气的实验现象是:
C中:_____________________;D中:_____________________________。
查看习题详情和答案>>
(17分)某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液
请根据实验回答问题:
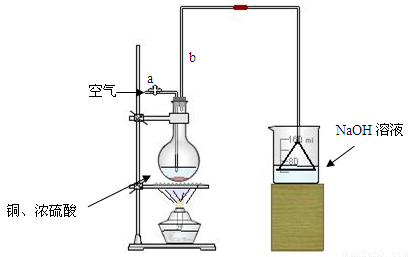
⑴首先根据上图所示,组装实验装置,并在加入试剂前先进行 操作。
⑵烧杯中用NaOH溶液吸收的物质是: (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是: 。
⑶加热烧瓶20分钟,烧瓶中发生反应的化学方程式是: 。待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
(填仪器名称)起到了确保硫酸体积保持不变的作用。
⑷将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行 、 、 后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的浓度最低是 。
⑸有的同学提出在上面⑷中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因:
。
查看习题详情和答案>>