网址:http://m.1010jiajiao.com/timu3_id_355960[举报]
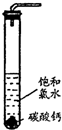 实验一、定性探究:
实验一、定性探究:①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因
 HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO
HClO+HCl,加入过量的CaCO3与溶液中的HCl发生反应,使盐酸的浓度减小,平衡向正反应方向移动,最终生成HClO(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:
第二份:
(3)试根据所学知识推测,在②的滤液中含 有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)
实验二、定量探究:
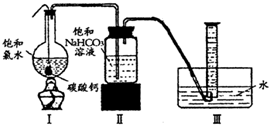
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,水槽中的水应换为
A.饱和碳酸钠溶液 B.饱和碳酸氢钠溶液 C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现
| BL |
| 22.4L/mol |
| Ag |
| 100g/mol |
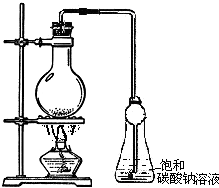 实验室用乙酸和乙醇在浓硫酸作用下反应制备乙酸乙酯,反应装置如右图:
实验室用乙酸和乙醇在浓硫酸作用下反应制备乙酸乙酯,反应装置如右图:已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH;②部分有机物的沸点如下:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.5 | 78.5 | 117.9 | 77 |
(1)写出制备乙酸乙酯的化学方程式
(2)浓硫酸的作用是
(3)用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为
(4)实验所得到的乙酸乙酯中常含有一定量的乙醇、乙醚和水,先加入无水氯化钙后过滤,可除去
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气.进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
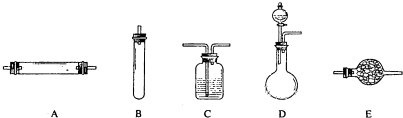
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置
(选填装置编号)中加入
(3)方法三:制氮气的化学方程式为:
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂.在制取氮气的3种方法中,联合使用方法-和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:
(5)1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
实验目的:探究过氧化钠与水反应后的溶液滴加酚酞试液先变红后退色的原因。
[分析与猜想]
(1)根据过氧化钠与水反应的原理:2Na2O2 + 2H2O =" 4NaOH" + O2↑,往过氧化钠固体完全溶解反应后的溶液中滴加酚酞本应只会变红而不会退色,而实验中发现酚酞变红后又退色。由此提出如下的猜想:
A.氧气有漂白性
B.氢氧化钠有漂白性
C.
[实验与判断] 请完成下列表格:
| 实验编号 | 1 | 2 | 3 |
| 实验装置 | 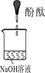 | 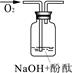 | 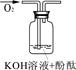 |
| 验证猜想 | | C | |
| 实验现象 | 溶液变红后不退色 | ||
| 实验说明 | 1、2的实验中NaOH溶液是用 (填“氢氧化钠固体”、“氧化钠固体”、“过氧化钠固体”)溶于水配制的。 | ||
(2)根据以上实验分析发现:过氧化钠与水反应过程中,钠元素形成了稳定的化合物,溶液中还生成了一种不很稳定、具有漂白性的物质X,X的化学式是 。
(3)可用右图装置对溶液中不很稳定的物质进行探究,在①处装入的物质是 (填选项,下同),②处装入的物质是 。
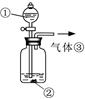
A.酚酞试剂 B.过氧化钠与水反应后的溶液
C.二氧化锰 D.氢氧化钠固体配制的溶液
(4)气体③是 ,过氧化钠与水反应的化学方程式没有写出X来,原因是 。 查看习题详情和答案>>
实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气。
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用_____________________(选填装置编号)。请写出生石灰在此反应中的两个作用:__________________________________,___________________________________________.
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_________________
(选填装置编号)中加入_________________________以除去其它杂质气体。
(3)方法三:制氮气的化学方程式为:_____________________________________________。
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂。在制取氮气的3种方法中,联合使用方法—和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:_____________
______________________________________________________________________________.
(5) 1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右。若上述实验设计与操作均无错误,且氮气已完全干燥,
请解释产生这一现象的原因:_______________________________________________.