摘要:7.接触法制硫酸中.进入接触室的气体的体积分数为SO27%.O211%.N282%.将100体积混合气体通入接触室反应后.导出的气体恢复到原状况时变为97.2体积.则SO2的转化率为 A.40% B.60% C.80% D.90%
网址:http://m.1010jiajiao.com/timu3_id_354490[举报]
硫酸工业在国民经济中占有极其重要的地位.
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g)
2SO3(g)△H=-98.3kJ?mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为
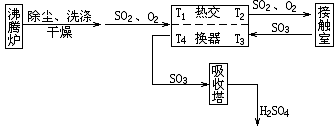
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔).
①三个设备分别使反应物之间或冷热气体间进行了“对流”.请简单描述吸收塔中反应物之间是怎样对流的.
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的.用化学方程式表示其反应原理.(只写出2个方程式即可)
查看习题详情和答案>>
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有
硫酸铵或硫酸氢铵或硫酸锌或硫酸钾
硫酸铵或硫酸氢铵或硫酸锌或硫酸钾
(任写一种).(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有
D
D
(填写序号).A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g)
| ||
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为
99.75%
99.75%
.(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔).
①三个设备分别使反应物之间或冷热气体间进行了“对流”.请简单描述吸收塔中反应物之间是怎样对流的.
从接触室中出来的热气体SO2、O2、N2、SO3,在吸收塔的底部进入,从下向上运动;
从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换.
从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换.
从接触室中出来的热气体SO2、O2、N2、SO3,在吸收塔的底部进入,从下向上运动;
从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换.
.从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换.
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的.用化学方程式表示其反应原理.(只写出2个方程式即可)
SO2+2NH3?H2O═(NH4)2SO3,(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O
SO2+2NH3?H2O═(NH4)2SO3,(NH4)2SO3+H2SO4═(NH4)2SO4+SO2↑+H2O
.接触法制硫酸的生产过程中,下列措施能提高硫酸的产率的是
- A.控制接触室内的温度在450℃左右
- B.沸腾炉中通入过量空气
- C.对炉气进行除尘、洗涤、干燥处理
- D.接触室中用V2O5作催化剂