网址:http://m.1010jiajiao.com/timu3_id_354134[举报]
(4分)铁的氧化物有多种用途。请解答下面有关问题:
(1)赤铁矿的主要成分是Fe2O3,是工业炼铁的主要原料之一。写出由Fe2O3制得单质铁的化学方程式 。某赤铁矿除了含Fe2O3之处,还含有少量的SiO2和Al2O3。将试样溶于NaOH溶液,充分反应过滤,即可得到较纯净的Fe2O3。发生反应的离子方程式是 。
(2)Fe2O3可以与铝粉组成铝热剂用于焊接钢轨或定向爆破。某同学猜测,该反应所得熔融物中含有Fe2O3。他设计如下实验来验证自己的猜想:取少量试样,加入足量 稀盐酸,然后滴加KSCN溶液,若出现血红色,证明含有Fe2O3。否则,不含有Fe2O3。
你认为该方案合理吗?为什么? 。
(3)合成氨工业中所用的α―Fe催化剂的主要成分是FeO、Fe2O3。已知当催化剂中Fe2+和Fe3+的物质的量之比为1:2时,其催化活性最高。某化学小组试图以Fe2O3为原料制备该催化剂,方法之一是向其中加入炭粉高温反应:
![]()
实验教师提供了12g炭粉。请你计算,若要制取这种活性最高的催化剂,加入的Fe2O3的质量为 g。 该小组设计了多个实验方案来测定所得产品是否符合要求。其中一个实验方案是用氢气还原加热的混合物,测定铁的质量分数。在用锌跟稀硫酸反应制取氢气时,该小组的同学向稀硫酸中加入少量硫酸铜溶液,目的是 。当混合物中铁的质量分数为 (用化简的分数表示)时,该产品合格。
查看习题详情和答案>>
(1)李同学利用1mol/L的硫酸、KSCN溶液、酸性高锰酸钾溶液,确定其组成.
| 编号 | 实验操作 | 实验现象与结论 |
| ① | 取少量粉末放入试管中,注入1mol/L的硫酸 | 粉末逐渐溶解,溶液呈黄绿色 |
| ② | 将“①”中所得溶液分成两份;向其中一份滴加几滴KSCN溶液,振荡 | 若溶液变为 血红色 血红色 ,说明有Fe2O3存在 |
| ③ | 在另一份中加入少量KMnO4溶液 | 若溶液 紫色褪去 紫色褪去 ,说明有FeO存在 |
| 浓硫酸 |
| △ |
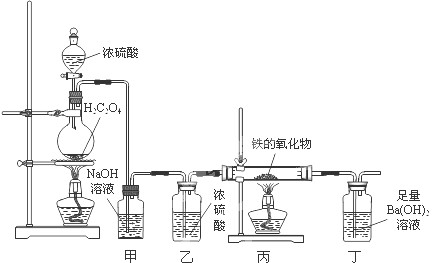
①装置甲的作用是
②实验开始时,王同学发现打开分液漏斗旋塞,浓硫酸无法滴下,原因是
③若丙中铁的氧化物质量为3.04g,完全反应后丁中生成沉淀的质量为9.85g.试通过计算确定该铁的氧化物的成分及其物质的量之比.

实验步骤如下:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有________。
(a)容量瓶________(b)烧杯________(c)烧瓶?
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是________。?
(a)控制溶液中Fe2+与Fe3+含量比?
(b)确定下一步还原所需铁的量?
(c)确定氧化Fe2+所需NaClO3的量?
(d)确保铁的氧化物酸溶完全?
(3)用NaClO3氧化时反应方程式如下:?
6FeSO4+NaClO3+3H2SO4![]() 3Fe2(SO4)3+NaCl+3H2O
3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下?
6FeSO4+2HNO3+3H2SO4![]() 3Fe2(SO4)3+NO↑+4H2
3Fe2(SO4)3+NO↑+4H2
已知1 mol HNO3价格为0.16元、1 mol NaClO3价格为0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是________,弊是________。
(4)聚合硫酸铁溶液中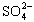 与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中
与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中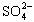 与Fe3+物质的量之比。?
与Fe3+物质的量之比。?
测定时所需的试剂________。?
(a) NaOH (b)FeSO4 (c) BaCl2 (d) NaClO3?
(5)需要测定________和________的质量(填写化合物的化学式)。?
(6)选出测定过程中所需的基本操作________(按操作先后顺序列出)。?
(a)萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶 (d)冷却、称量 (e)烘干或灼烧?
查看习题详情和答案>>硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。?
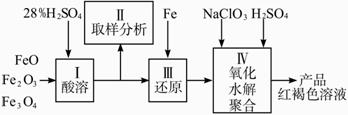
实验步骤如下:
(1)用98%的硫酸配制28%的硫酸,所需的玻璃仪器除量筒外,还有________。
(a)容量瓶________(b)烧杯________(c)烧瓶?
(2)步骤Ⅱ取样分析溶液中的Fe2+、Fe3+的含量,目的是________。?
(a)控制溶液中Fe2+与Fe3+含量比?
(b)确定下一步还原所需铁的量?
(c)确定氧化Fe2+所需NaClO3的量?
(d)确保铁的氧化物酸溶完全?
(3)用NaClO3氧化时反应方程式如下:?
6FeSO4+NaClO3+3H2SO4![]() 3Fe2(SO4)3+NaCl+3H2O
3Fe2(SO4)3+NaCl+3H2O
若改用HNO3氧化,则反应方程式如下?
6FeSO4+2HNO3+3H2SO4![]() 3Fe2(SO4)3+NO↑+4H2
3Fe2(SO4)3+NO↑+4H2
已知1 mol HNO3价格为0.16元、1 mol NaClO3价格为0.45元,评价用HNO3代替NaClO3作氧化剂的利弊,利是________,弊是________。
(4)聚合硫酸铁溶液中SO42-与Fe3+物质的量之比不是3∶2。根据下列供选择的试剂和基本操作,测定聚合硫酸铁产品溶液中SO42-与Fe3+物质的量之比。?
测定时所需的试剂________。?
(a) NaOH (b)FeSO4 (c) BaCl2 (d) NaClO3?
(5)需要测定________和________的质量(填写化合物的化学式)。?
(6)选出测定过程中所需的基本操作________(按操作先后顺序列出)。?
(a)萃取、分液 (b)过滤、洗涤 (c)蒸发、结晶 (d)冷却、称量 (e)烘干或灼烧?
查看习题详情和答案>>