摘要:23.(1)4HCl+MnO2MnCl2+2H2O+Cl2↑ (2)2Cl2+2H2O(气)+C4HCl↑+CO2↑吸收Cl2中的HCl气体.提供D处所需水蒸气. (3)生成的HCl气体使紫色石蕊溶液变红.因未反应完的Cl2与H2O作用产生的HClO的漂白作用使红色消失. (4)B (5)瓶中液面下降.长颈漏斗内液面上升.贮存少量Cl2.
网址:http://m.1010jiajiao.com/timu3_id_354081[举报]
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.现将17.4gMnO2与200克36.5%的浓盐酸(过量)完全反应.把反应后所得溶液稀释成400ml.计算(保留3位有效数字要求写出计算过程):(相对原子质量Mn:55 O:16 H:1 Cl:35.5)
(1)生成的Cl2的体积(标准状况).
(2)参加反应的HCl的物质的量.
(3)稀释后溶液Cl-的物质的量浓度是多少?
查看习题详情和答案>>
| ||
(1)生成的Cl2的体积(标准状况).
(2)参加反应的HCl的物质的量.
(3)稀释后溶液Cl-的物质的量浓度是多少?
已知实验室制氯气的化学方程式为:MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O,其中:
(1)MnO2中Mn元素被
(2)HCl中氯原子
(3)反应中还原剂与氧化剂的物质的量之比为
(4)若参加反应的HCl是146g,则被氧化的HCl是
(5)用单线桥法表示此反应中电子转移情况.MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O.
查看习题详情和答案>>
(1)MnO2中Mn元素被
还原
还原
.(2)HCl中氯原子
失去
失去
(填“得到”或“失去”)电子.(3)反应中还原剂与氧化剂的物质的量之比为
2:1
2:1
.(4)若参加反应的HCl是146g,则被氧化的HCl是
2
2
mol.(5)用单线桥法表示此反应中电子转移情况.MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O.
(2011?闵行区二模)现有七种物质PbO2、MnSO4、Pb(NO3)2、PbSO4、HNO3、HMnO4、H2O组成一个化学方程式,已知PbO2等三种物质为反应物,PbSO4难溶于水.
(1)写出并配平该反应的化学方程式
(2)反应中被氧化的是
(3)把反应后的溶液稀释到1L,测出其中的Pb2+的浓度为0.6mol/L,则反应中转移的电子数为
(4)根据上述反应中氧化剂的强弱,判断PbO2与浓盐酸的化学方程式正确的是
A.PbO2+4HCl→PbCl4+2H2O
B.PbO2+4HCl→PbCl2+2H2O+Cl2↑
C.PbO2+2HCl+2H+→PbCl2+2H2O
D.PbO2+2HCl→PbCl2+2OH-.
查看习题详情和答案>>
(1)写出并配平该反应的化学方程式
5PbO2+2MnSO4+6HNO3 ═3Pb(NO3)2+2PbSO4↓+2HMnO4+2H2O
5PbO2+2MnSO4+6HNO3 ═3Pb(NO3)2+2PbSO4↓+2HMnO4+2H2O
.(2)反应中被氧化的是
+2价的Mn
+2价的Mn
元素,HNO3在反应中显示酸
酸
性.(3)把反应后的溶液稀释到1L,测出其中的Pb2+的浓度为0.6mol/L,则反应中转移的电子数为
2
2
mol.(4)根据上述反应中氧化剂的强弱,判断PbO2与浓盐酸的化学方程式正确的是
B
B
.A.PbO2+4HCl→PbCl4+2H2O
B.PbO2+4HCl→PbCl2+2H2O+Cl2↑
C.PbO2+2HCl+2H+→PbCl2+2H2O
D.PbO2+2HCl→PbCl2+2OH-.
(15分)下图是一套制取并验证氯 气部分化学性质的实验装置。
气部分化学性质的实验装置。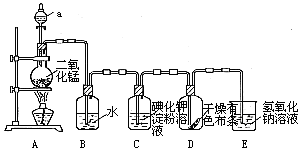
反应的方程式:MnO2+4HCl(浓) MnCl2+2H2O+ Cl2↑回答下列问题:
MnCl2+2H2O+ Cl2↑回答下列问题:
(1)上述反应中氧化剂是____ ,还原剂是__ __。
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值____7(填“>”“<”或“=”),写出Cl2与水反应的方程式 .
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为_ ___色,反应的离子方程式为 _,这个实验证明氯气的氧化性比碘单质 _ ___(填“强”或“弱”).
(4)当Cl2气流持续通过时装置D中干燥的有色布条能否褪色?为什么?
。
(5)装置E的作用是__ _。
(6)制取标况下氯气4.48升,至少需要MnO2 克。(Mn-55,O-16)
 MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中