摘要:14.在-50℃时液氨中存在着下列平衡:2NH3(l) NH+4+NH-2.两种离子的平衡浓度均为1.0×10-15mol·L-1.以下有关-50℃时液氨的叙述中正确的是 A.离子积为1.0×10-15 B.向液氨中加入金属钠.平衡不移动 C.向液氨中加入氨基钠(NaNH2).液氨的离子积不变 D.向液氨中加入NH4Cl.c(NH+4)增大.离子积的数值也随之增大
网址:http://m.1010jiajiao.com/timu3_id_353731[举报]
在-50℃时液氨中存在着下列平衡:2NH3(l)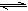
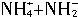 ,两种离子的平衡浓度均为1.0×10-15mol?L-1。以下有关-50℃时液氨的离子积的叙述中正确的是( )。
,两种离子的平衡浓度均为1.0×10-15mol?L-1。以下有关-50℃时液氨的离子积的叙述中正确的是( )。
A.离子积为1.0×10-15mol?L-1
B.离子积为1.0×10-30mol2?L-2
C.向液氨中加入氨基钠(NaNH2),离子积的数值不变
D.向液氨中加入NH4Cl,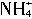 浓度增大,离子积的数值也随之增大
查看习题详情和答案>>
浓度增大,离子积的数值也随之增大
查看习题详情和答案>>
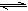
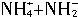 ,两种离子的平衡浓度均为1.0×10-15mol?L-1。以下有关-50℃时液氨的离子积的叙述中正确的是( )。
,两种离子的平衡浓度均为1.0×10-15mol?L-1。以下有关-50℃时液氨的离子积的叙述中正确的是( )。A.离子积为1.0×10-15mol?L-1
B.离子积为1.0×10-30mol2?L-2
C.向液氨中加入氨基钠(NaNH2),离子积的数值不变
D.向液氨中加入NH4Cl,
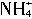 浓度增大,离子积的数值也随之增大
查看习题详情和答案>>
浓度增大,离子积的数值也随之增大
查看习题详情和答案>>
在-50 ℃时液氨中有2NH3(液)  NH4++NH2—电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
NH4++NH2—电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
A.电离平衡常数是1×10-15
B.不加入其他物质,液氨中c(NH4+)=c(NH2—)
C.降低温度,其电离平衡常数数值增加
D.此液氨中放入NH4Cl,其电离平衡常数的数值增加
查看习题详情和答案>>
在-50 ℃时液氨中有2NH3(液)  NH+NH电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
NH+NH电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
| A.电离平衡常数是1×10-15 |
| B.不加入其他物质,液氨中c(NH)=c(NH) |
| C.降低温度,其电离平衡常数数值增加 |
| D.此液氨中放入NH4Cl,其电离平衡常数的数值增加 |
在-50 ℃时液氨中有2NH3(液)  NH4++NH2—电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
NH4++NH2—电离平衡关系,两离子的平衡浓度均为1×10-15mol·L-1,下列对-50 ℃时液氨的电离平衡常数的表达中正确的是
| A.电离平衡常数是1×10-15 |
| B.不加入其他物质,液氨中c(NH4+)=c(NH2—) |
| C.降低温度,其电离平衡常数数值增加 |
| D.此液氨中放入NH4Cl,其电离平衡常数的数值增加 |
已知4℃时四种化合物在水中和液氨中的溶解度如下表:
| AgNO3 | Ba (NO3)2 | AgCl | BaCl2 | |
| H2O(l) | 170g | 9.20g | 1.50×10-4g | 33.3g |
| NH3(l) | 86.0g | 97.2g | 0.80g | 0.00g |
①上述四种物质能在水中发生的复分解反应为___________________________;
②能在液氨中发生的复分解反应为_____________________________________。
查看习题详情和答案>>