网址:http://m.1010jiajiao.com/timu3_id_353324[举报]
过氧化钠(Na2O2)是中学常见物质。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,能被过氧化钠氧化生成硫酸钠,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:假设1:反应后固体中只有________,证明SO2未被氧化;
假设2:反应后固体中只有________,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:实验二:通过测量气体的体积判断发生的化学反应,实验装置如下: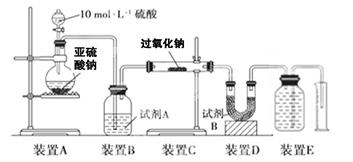
(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断, SO2未被氧化时、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
过氧化钠(Na2O2)是中学常见物质。已知:过氧化钠与CO2反应有气体生成,而将SO2通入过氧化钠粉末中也有气体生成。有人提出CO2、SO2与过氧化钠的反应原理相同,但也有人提出SO2具有较强的还原性,能被过氧化钠氧化生成硫酸钠,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断。
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:假设1:反应后固体中只有________,证明SO2未被氧化;
假设2:反应后固体中只有________,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:

(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断, SO2未被氧化时、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
查看习题详情和答案>>
实验一:向一定量的过氧化钠固体中通入足量的SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(1)提出假设:假设1:反应后固体中只有________,证明SO2未被氧化;
假设2:反应后固体中只有________,证明SO2完全被氧化;
假设3:__________________________证明______________________。
实验探究:实验二:通过测量气体的体积判断发生的化学反应,实验装置如下:
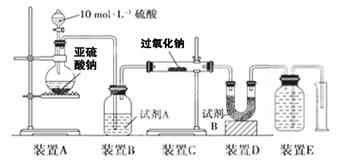
(2)试剂A可以选用________,试剂B的作用是________。
(3)实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据判断, SO2未被氧化时、完全被氧化的V-m1关系式。
未被氧化:____________,完全被氧化:____________。
(4)若SO2完全被氧化,写出反应的化学方程式: __________________________。
(Ⅰ)据著名网站-网易报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构.
(1)下列有关O4的说法正确的是________
A、O4分子内存在极性共价键B、合成O4的反应可看作核聚变反应,即不属于化学变化
C、O4与O3、O2都是氧的同素异形体D、O4将来可用作更强有力的火箭推进的氧化剂
(2)含O2-、O22-甚至O2+的化合物是可能存在的,通常它们是在氧分子进行下列各种反应时生成的:该反应中________(填序号)相当于氧分子的还原.

(3)化合物O2[PtF6]中含有O![]() ,有一种常见的含有O
,有一种常见的含有O![]() 的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:________
的氧化物可用作宇宙飞船中氧气来源,写出该反应的化学方程式:________
(Ⅱ)《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13∶1,NO3-的比例呈明显上升的趋势.
回答下列问题:
⑴江苏省大气污染特征是________
A、煤烟型B、机动车尾气型C、由煤烟型向煤烟型与机动车尾气混合型转化
D、由机动车尾气型向煤烟型与机动车尾气混合型转化
⑵某研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究.
①如果你参加该课题的探究,在讨论测定地点时,你建议选择的地点分别是________.
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/T15262-94)规定用甲醛溶液吸收二氧化硫.变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是________.
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸:
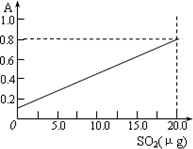
HCHO+H2SO3→![]()
该反应类型属于________.测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确定二氧化硫的含量.实验测得SO2含量与溶液的吸光度A的关系如右上图所示.若欲测定某地空气中二氧化硫的含量(mg·m-3),除需要测定吸光度A外还需要记录的数据为________.
乙二酸(H2C2O4)俗称草酸,是一种重要的化工原料。查阅资料,了解到以下有关信息:
①乙二酸易溶于水,加热至100℃开始升华,125℃时迅速升华,157℃时大量升华并开始分解。乙二酸受热分解生成水、二氧化碳和一种常见的还原性气体。
②乙二酸的钙盐——乙二酸钙为不溶于水的白色晶体。某校化学研究性学习小组为探究草酸的部分性质,进行了如下实验:
(1)为比较相同浓度的草酸和硫酸的导电性,实验室需配制100 mL 0.1mol/L的草酸溶液,配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒、_____ 、____。
(2)化学兴趣小组的同学用实验证明乙二酸晶体受热分解生成的气体成分。他们利用下图提供的装置,自选试剂,提出了下列实验方案:按A→B→C→C→C→D→E顺序从左至右连接装置,检验乙二酸晶体受热分解生成的气体成分。请你按整套装置从左至右的顺序填写下表中的空格:


①请写出乙二酸受热分解的化学方程式 _______。
②上述实验中能说明乙二酸热分解生成了还原性气体的实验现象是____。
③检验乙二酸具有较强的还原性,通常选用的试剂是____。
查看习题详情和答案>>