网址:http://m.1010jiajiao.com/timu3_id_353213[举报]
(1)在用KMnO4酸性溶液处理Cu2S和FeS2的混合物时,发生的反应如下:
Ⅰ、MnO4ˉ+Cu2S+H+→Cu2++SO42ˉ+Mn2++H2O(未配平)
Ⅱ、MnO4ˉ+FeS2+H+→Fe3++SO42ˉ+Mn2++H2O(未配平)
①下列关于反应Ⅰ的说法正确的是
A、MnO4ˉ是氧化剂,Cu2S既是氧化剂又是还原剂
B、氧化剂与还原剂的物质的量之比为5:8
C、每生成1mol SO42ˉ,反应转移电子的物质的量为10mol
②若反应Ⅰ和反应Ⅱ中消耗的KMnO4的物质的量相同,则反应Ⅰ和反应Ⅱ中消耗的还原剂的物质的量之比为
(2)KMnO4、双氧水、活性炭常用于饮用水的处理,但三者在联合使用时必须有先后顺序.
①氧化反应:H2O2-2eˉ→2H++O2↑
还原反应:MnO4ˉ+5eˉ+8H+→Mn2++4H2O
写出该氧化还原反应的化学方程式
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投放,否则会发生KMnO4+C+H2O→MnO2+X+K2CO3(未配平),其中X的化学式为

(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为:
(2)装置B的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入
| a | b | c | |
| I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(10分)高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾。下面是实验室制取高锰酸钾的过程:
①称取15g固体KOH和8g固体KClO3,导入坩埚内,混合均匀,小火加热,并用铁棒搅拌。待混合物熔融后,一面搅拌,一面将10gMnO2粉末分批加入。随着反应的进行,熔融物的粘度逐渐增大,此时用力搅拌,待反应物干涸后,再强热5~10min。
②待熔体冷却后,从坩埚内取出,放入250mL烧杯中,用80mL蒸馏水分批浸取,并不断搅拌,加热以促进其溶解。趁热减压过滤浸取液,即可得到墨绿色的K2MnO4溶液。
③将K2MnO4溶液倒入烧杯中,加热至60℃,按如图所示进行电解。阳极是光滑的镍片,卷成圆筒状,阴极为粗铁丝。接通直流电源,高锰酸钾在阳极析出沉于烧杯底部,溶液由墨绿色逐渐转为紫红色,电解1h后,停止通电,取出电极。在冷水中冷却电解液,使结晶完全,用玻璃砂布氏漏斗将晶体抽干,称重,计算产率。
回答下列问题:
(1)步骤①发生的反应方程式为______________________________
(2)步骤①中共熔时要选择__________坩埚(填“铁”、“陶瓷”或“石英”)。
(3)写出步骤③中发生的电极反应式:
阳极____________________________ 阴极________________________
(4)实验中用到抽滤操作,抽滤装置如下图所示,仪器B的名称是___________。抽滤完毕,吸滤瓶内的液体从_____________________倒出。步骤③抽滤时使用玻璃砂布氏漏斗的原因是_________________________________________________
查看习题详情和答案>>
(10分)高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾。下面是实验室制取高锰酸钾的过程:
①称取15g固体KOH和8g固体KClO3,导入坩埚内,混合均匀,小火加热,并用铁棒搅拌。待混合物熔融后,一面搅拌,一面将10gMnO2粉末分批加入。随着反应的进行,熔融物的粘度逐渐增大,此时用力搅拌,待反应物干涸后,再强热5~10min。
②待熔体冷却后,从坩埚内取出,放入250mL烧杯中,用80mL蒸馏水分批浸取,并不断搅拌,加热以促进其溶解。趁热减压过滤浸取液,即可得到墨绿色的K2MnO4溶液。
③将K2MnO4溶液倒入烧杯中,加热至60℃,按如图所示进行电解。阳极是光滑的镍片,卷成圆筒状,阴极为粗铁丝。接通直流电源,高锰酸钾在阳极析出沉于烧杯底部,溶液由墨绿色逐渐转为紫红色,电解1h后,停止通电,取出电极。在冷水中冷却电解液,使结晶完全,用玻璃砂布氏漏斗将晶体抽干,称重,计算产率。
回答下列问题:
(1)步骤①发生的反应方程式为______________________________
(2)步骤①中共熔时要选择__________坩埚(填“铁”、“陶瓷”或“石英”)。
(3)写出步骤③中发生的电极反应式:
阳极____________________________ 阴极________________________
(4)实验中用到抽滤操作,抽滤装置如下图所示,仪器B的名称是___________。抽滤完毕,吸滤瓶内的液体从_____________________倒出。步骤③抽滤时使用玻璃砂布氏漏斗的原因是_________________________________________________
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
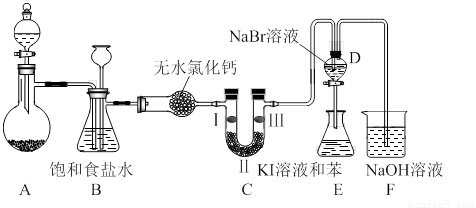
(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为: 。
(2)装置B的作用是 ,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入 。(选a或b或c)
|
|
a |
b |
c |
|
I |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
|
II |
碱石灰 |
浓硫酸 |
无水氯化钙 |
|
III |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。打开活塞,将D中的少量溶液加入E中,振荡E。观察到的现象是 。该现象 (填“能”或“不能”)说明溴的非金属性强于碘,原因是 。
查看习题详情和答案>>