摘要:△ 1.化学性质 或光 (1)不稳定性 4HNO3 == 2H2O + 4NO2 + O2↑硝酸越浓越易分解. 由于分解产生NO2又溶解到HNO3里.而呈黄色.久置的试剂颜色变化的较多.如: Na2O2. .Fe2+化合物.AgX.AgNO3等. 思考:久置变黄的硝酸如何除去黄色? (通入过量O2.不能加水.否则浓HNO3变成稀HNO3) (2)强氧化性--越浓氧化性越强 ①使Fe.Al钝化 ②除Au 和Pt可溶解绝大多数金属.要使Au.Pt溶解可用王水 思考:①王水.实验室制取CH4.C2H4均存在1:3关系.问这1:3是指体积.质量还是物质的量? ②(王水中浓HNO3和浓盐酸物质的量比1:3.制CH4无水CH3COONa与碱石灰质量比约为1:3.制C2H4酒精与浓H2SO4体积比为1:3) ③5.6g铁粉与100g稀HNO3恰好反应.求硝酸的质量分数. (Fe与硝酸反应.应有以下几种情况:a.Fe + 4HNO3 = Fe(NO3)3 + NO↑+ 2H2O. A% = 25.2% b.3Fe + 8HNO3 = 3Fe(NO3)2 + 2NO↑+ 4H2O.A% =16.8% C.所得产物为Fe(NO3)3和Fe(NO3)2混合物.则应在16.8~25.2%之间) ④氧化非金属.如C.S.P.且氧化到最高价 ⑤某些化合物.如S2-.SO42-.Fe2+.I-等 (3)与有机物的反应 ① + HNO3 + H2O 进行该实验的操作步骤?实验现象?为何制得的硝基苯为谈黄色?怎样将淡黄色除去得到纯硝基苯? ②与醇.纤维素的酯化 ③与蛋白质发生黄蛋白反应 △ 2.制法 (1)实验室制法 NaNO3 + H2SO4(浓)==== NaHSO4 + HNO3↑ 实验室制HNO3的原理与制HCl完全相同.为什么制HNO3的产物只能为NaHSO4而不是Na2SO4?制HNO3发生装置是否与制Cl2完全相同? (因为若生成Na2SO4必强热.这时HNO3亦分解.不同.一般制HNO3只能用曲颈瓶.若用与制Cl2相同的装置.橡皮塞应用铝箔包起来.) (2)工业制法--氨的催化氧化法 ①氨的氧化--氧化炉 高温 ②从氧化炉出来的气体(NO)必需经冷却再与O2反应.为什么? (高温NO不能与O2化合.即2NO2 ===2NO + O2) ③尾气吸收--用NaOH溶液 ④稀NHO3浓缩--吸水剂Mg(NO3)2或浓H2SO4再蒸馏. 思考:吸水剂能否用MgCl2或P2O5? (不能用MgCl2.因为蒸馏时HNO3中含HCl.可用P2O5.因形成H3PO4也是不挥发性酸) 例:氨氧化法可制得50%的硝酸.加脱水剂可进一步制得90%的硝酸.两种产品的质量比(m1.m2分别为50%的硝酸溶液和90%的硝酸溶液质量).若以17吨液氨为原料生产硝酸 (1)导出理论上所需水量y(吨)与质量比x数学关系式(假定NH3转化率是100%) (2)根据导出关系式求出只生产50%的硝酸所需水的量和只生产90%硝酸所需水的量(吨) (3)质量比x为多少时.进出水的量保持平衡.此时两种产品总质量为多少吨? 解析:这是一道结合数学知识解决化工生产的典型例题.高考明确指出: 要具备用数学知识解决化学问题的能力. 本题首先要导出需要水的量与两种硝酸质量比的函数关系: 两种产品中含水为吨.这是否理论上需要水的量?不是.因为在NH3 + 2O2 = HNO3 + H2O反应中.17吨氨除完全转化为63吨硝酸外.还生成18吨水.因此-18.现在的问题是如何将m1.m2转化为x.根据题意: 代入-18 得 解答第二问.关键是抓住“根据导出关系式 .而不是利用化学方程式求解.如何根据导出关系式求出需要水的量?还要抓住.当只生产50%硝酸时.即m2=0.若m2=0. 即吨.需加入45吨水.当只生产90%硝酸时.m1=0. x=0.吨.这-11吨什么意思?即不需要加水.反而脱去11吨水.才能得到90%的硝酸. 第三问比较简单.当进出水的量保持平衡.即y=0.. 利用方程组 求出 两种产品的总质量为24.75+56.25=81吨
网址:http://m.1010jiajiao.com/timu3_id_352925[举报]
实验室要用98%(密度为1.84g?cm-3)的硫酸配制3.68mol/L的硫酸500mL.实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解
④转移、洗涤 ⑤定容、摇匀
回答下列问题
(1)需准确量取98%的硫酸
(从下列中选用 A.10ml B.20ml C.50ml D.100ml)
(2)要配制3.68mol/L的硫酸500mL,必须用到的仪器是(填写序号)
①500mL量筒 ②烧杯 ③1 000mL容量瓶 ④500mL容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol/L的硫酸,其他操作均正确,下列操作会使所配硫酸溶液浓度偏低的是
A.将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外
C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切
D.用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切
E.所用的浓硫酸长时间放置在密封不好的容器中
(4)若配制时,因加水不慎超过了容量瓶刻度线,此时实验应如何继续进行?
查看习题详情和答案>>
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解
④转移、洗涤 ⑤定容、摇匀
回答下列问题
(1)需准确量取98%的硫酸
100
100
mL.量取浓硫酸所用的量筒的规格是D
D
(从下列中选用 A.10ml B.20ml C.50ml D.100ml)
(2)要配制3.68mol/L的硫酸500mL,必须用到的仪器是(填写序号)
②④⑥⑧
②④⑥⑧
.①500mL量筒 ②烧杯 ③1 000mL容量瓶 ④500mL容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol/L的硫酸,其他操作均正确,下列操作会使所配硫酸溶液浓度偏低的是
ABCDE
ABCDE
(选填序号).A.将稀释的硫酸转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的稀硫酸向容量瓶内转移时,因操作不当使部分稀硫酸溅出瓶外
C.用胶头滴管向容量瓶中加水时凹液面高于容量瓶刻度线,此时立即用胶头滴管将瓶内多余液体吸出,使溶液凹液面与刻度线相切
D.用胶头滴管向容量瓶中加入水时,仰视观察溶液凹液面与容量瓶刻度线相切
E.所用的浓硫酸长时间放置在密封不好的容器中
(4)若配制时,因加水不慎超过了容量瓶刻度线,此时实验应如何继续进行?
重新配置
重新配置
.实验室要配制1.0mol/L的NaOH溶液500mL.
(1)需称取固体NaOH
(2)要配制1.0mol/L的NaOH溶液500mL,除了用托盘天平外,还要用到的仪器是(填写序号,错选不给分,少选没错给1分)
①500mL量筒 ②烧杯 ③1 000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥胶头滴管
(3)若其他操作均正确,下列操作会使所配的NaOH溶液浓度偏低的是
A.将溶解的NaOH溶液转移至容量瓶后,没有洗涤烧杯和玻璃棒.
B.将烧杯内的NaOH溶液向容量瓶内转移时,因操作不当使部分NaOH溶液溅出瓶外.
C.加水未达到刻度线.
D.摇匀后,发现液面低于刻度线,再滴加蒸馏水至刻度线.
(4)若配制时,因加水不慎超过了容量瓶刻度线,此时实验应如何继续进行?
A.用胶头滴管把超过刻度线的水吸出.
B.再加入一点NaOH固体.
C.将容量瓶中的溶液倒出洗涤干净后,再重新配制.
查看习题详情和答案>>
(1)需称取固体NaOH
2.0
2.0
克.(2)要配制1.0mol/L的NaOH溶液500mL,除了用托盘天平外,还要用到的仪器是(填写序号,错选不给分,少选没错给1分)
②④⑤⑥
②④⑤⑥
.①500mL量筒 ②烧杯 ③1 000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥胶头滴管
(3)若其他操作均正确,下列操作会使所配的NaOH溶液浓度偏低的是
ABD
ABD
.A.将溶解的NaOH溶液转移至容量瓶后,没有洗涤烧杯和玻璃棒.
B.将烧杯内的NaOH溶液向容量瓶内转移时,因操作不当使部分NaOH溶液溅出瓶外.
C.加水未达到刻度线.
D.摇匀后,发现液面低于刻度线,再滴加蒸馏水至刻度线.
(4)若配制时,因加水不慎超过了容量瓶刻度线,此时实验应如何继续进行?
C
C
.A.用胶头滴管把超过刻度线的水吸出.
B.再加入一点NaOH固体.
C.将容量瓶中的溶液倒出洗涤干净后,再重新配制.
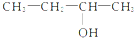 3-丁醇
3-丁醇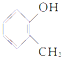 甲基苯酚
甲基苯酚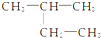 2-甲基丁烷
2-甲基丁烷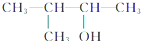 2-甲基-3-丁醇
2-甲基-3-丁醇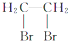 二溴乙烷
二溴乙烷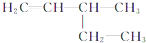 3-乙基-1-丁烯
3-乙基-1-丁烯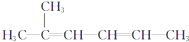 2-甲基-2,4-已二烯
2-甲基-2,4-已二烯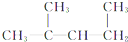 1,3-二甲基-2-丁烯
1,3-二甲基-2-丁烯