摘要:2.化学性质 (1)水解:NH4+ + H2O == NH3·H2O + H+ 思考:①请写出NH4+在D2O中水解的离子方程式 (NH4+ + D2O == NH3·HDO + D+ 或NH3·HDO + D3O+) ②试用平衡移动原理解释下列现象:氨水加入Mg2+溶液出现白色沉淀Mg(OH)2而Mg(OH)2加入到饱和NH4Cl溶液沉淀又能溶解. ③Mg(OH)2能溶于饱和NH4Cl溶液有两种解释.一种是: Mg(OH)2(s)== Mg2+ + 2OH-.NH4+ + H2O == NH3·H2O + H+.H+与OH-中和.促使Mg(OH)2的溶解平衡移动而溶解.另一种解释是: Mg(OH)2(s)== Mg2+ + 2OH-.OH- + NH4+ ==NH3·H2O.使Mg(OH)2 溶解. 试问:你能否只用一种试剂验证哪种解释合理? △ (答:用CH3COONH4.因为该溶液呈中性.若Mg(OH)2加入CH3COONH4溶液溶解.则第二种解释合理.若不溶解.第一种解释合理) (2)与碱反应:NH4+ + OH- == NH3↑+ H2O 注意:①该反应要生成NH3.必须要有加热条件.否则只能写成NH3·H2O ②该反应有何重要应用?一是实验室利用该反应来制取NH3.二是利用该反应检验或鉴定NH4+.请你说出鉴定NH4+方法? (取样品加入NaOH溶液加热.若有使湿润的红色石蕊试纸变蓝的气体产生.即含NH4+) △ (3)受热分解:一般规律是:若为非氧化性酸形成的铵盐.受热分解成NH3和对应的酸.如:NH4Cl == NH3 + HCl.NH4HCO3 == NH3↑+ H2O + CO2↑. (NH)2S == 2NH3 + H2↑+ S 若为氧化性酸形成的铵盐.受热分解发生氧化-还原反应.产物复杂一般不要求同学们掌握. 思考:①铵盐分解的实质是NH4+提供质子(H+)给酸根离子.则NH4F.NH4Cl.NH4Br.NH4I四种铵盐的热稳定性由大到小的顺序是 (NH4I> NH4Br> NH4Cl>NH4F.因为HF最弱.F-最易分解) ②硫酸铵受分解的产物是N2.SO2.NH3.H2O和SO3.问该反应中每转移1mol电子.有多少摩(NH4)2SO4分解? (首先写出反应方程式 4(NH4)2SO4 == N2 + 3SO2 + SO3 + 6NH3 + 7H2O.根据反应式.每生成1mol/N2转移6mol电子.即有4mol(NH4)2SO4分解.则转移1mol电子应有即mol(NH4)2SO4分解)
网址:http://m.1010jiajiao.com/timu3_id_352924[举报]
某课外活动小组对甲酸(HCOOH)进行了如下的实验,以验证其含有醛基,并考察其化学性质,首先做了银镜反应.
(1)某同学很成功的做了银镜反应,他肯定没有进行的操作
A.用洁净的试管;
B.在浓度为2%的NH3?H2O中滴入稍过量的浓度为2%的硝酸银;
C.用前几天配制好的银氨溶液;
D.在银氨溶液里加入稍过量的甲酸;
E.用小火对试管直接加热;
F.反应过程中,振荡试管使之充分反应.
然后,同学们对甲酸与甲醇进行了酯化反应的研究:
(2)乙装置中长导管A的作用是
(3)写出甲酸和甲醇进行酯化反应的化学方程式
(4)选择甲装置还是乙装置好?
(5)一同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,请给予合理的解释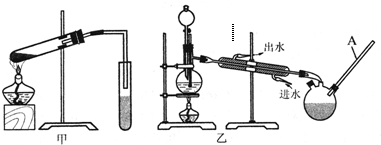
查看习题详情和答案>>
(1)某同学很成功的做了银镜反应,他肯定没有进行的操作
B、C、D、E、F
B、C、D、E、F
(写字母):A.用洁净的试管;
B.在浓度为2%的NH3?H2O中滴入稍过量的浓度为2%的硝酸银;
C.用前几天配制好的银氨溶液;
D.在银氨溶液里加入稍过量的甲酸;
E.用小火对试管直接加热;
F.反应过程中,振荡试管使之充分反应.
然后,同学们对甲酸与甲醇进行了酯化反应的研究:
(2)乙装置中长导管A的作用是
冷凝回流甲醇,平衡内外大气压强.
冷凝回流甲醇,平衡内外大气压强.
.(3)写出甲酸和甲醇进行酯化反应的化学方程式
HCOOH+CH3OH
HCOOCH3+H2O
| 浓H2SO4 |
| 加热 |
HCOOH+CH3OH
HCOOCH3+H2O
| 浓H2SO4 |
| 加热 |
(4)选择甲装置还是乙装置好?
乙
乙
,原因是因为甲醇有毒,需密封操作
因为甲醇有毒,需密封操作
.(5)一同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,请给予合理的解释
甲酸甲酯在NaOH溶液中发生水解
甲酸甲酯在NaOH溶液中发生水解
.
(2013?江苏三模)硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质.精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用.下图是生产精制硅藻土并获得Al(OH)3的工艺流程.
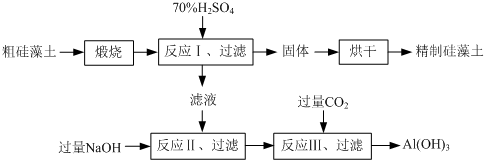
(1)粗硅藻土高温煅烧的目的是
(2)反应Ⅲ中生成Al(OH)3沉淀的化学方程式是
(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解.
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液.
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤.
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70℃水浴加热使其充分水解(K2SiF6+3H2O═H2SiO3+4HF+2KF).
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol?L-1NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL.
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有
a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是
④步骤4中滴定终点的现象为
⑤样品中SiO2的质量分数可用公式“w(SiO2)=
×100%”进行计算.由此分析步骤5中滴定反应的离子方程式为
查看习题详情和答案>>

(1)粗硅藻土高温煅烧的目的是
除去有机质
除去有机质
.(2)反应Ⅲ中生成Al(OH)3沉淀的化学方程式是
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
;氢氧化铝常用作阻燃剂,其原因是氢氧化铝分解吸收热量,且生成高熔点的氧化铝覆盖在表面
氢氧化铝分解吸收热量,且生成高熔点的氧化铝覆盖在表面
.(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解.
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液.
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤.
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70℃水浴加热使其充分水解(K2SiF6+3H2O═H2SiO3+4HF+2KF).
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol?L-1NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL.
①步骤1中高温灼烧实验所需的仪器除三角架、泥三角、酒精喷灯外还有
d
d
.a.蒸发皿 b.表面皿 c.瓷坩埚 d.铁坩埚
②实验中使用塑料烧杯和塑料漏斗的原因是
实验中产生的HF能与玻璃仪器中的SiO2等物质反应
实验中产生的HF能与玻璃仪器中的SiO2等物质反应
.③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是
洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失
洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失
.④步骤4中滴定终点的现象为
最后一滴滴入后溶液由无色变为粉红色,且30s不褪色
最后一滴滴入后溶液由无色变为粉红色,且30s不褪色
.⑤样品中SiO2的质量分数可用公式“w(SiO2)=
| 15cV×10-3 | a |
HF+OH-=F-+H2O
HF+OH-=F-+H2O
.由本题所给的①、②两条信息,结合已学知识,回答下列问题.
①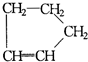 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(
,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基( ),这两步反应合在一起,称为“烯键的臭氧分解”.例如:
),这两步反应合在一起,称为“烯键的臭氧分解”.例如:


(1)写出异戊二烯臭氧分解的各种产物的结构简式
(2)a mol某烃CnH2n-2(该分子中无-C≡C-)和 结构),发生臭氧分解后,测得有机产物中含有羰基(
结构),发生臭氧分解后,测得有机产物中含有羰基( )b mol,则a和b的代数关系是:
)b mol,则a和b的代数关系是:
(3)写出由环己醇( )和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
)和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
(4)某烃A的化学式为C10H16,A经臭氧分解可得到等物质的量的两种产物,其结构简式分别为HCHO和 .A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
.A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
 ,B
,B
 .
.
(5)从香精油中分离到一种化合物[A](C10H16),1mol[A]在催化加氢时可吸收2mol氢气;1mol[A]经臭氧氧化反应再加锌粉水解可得到1mol丙酮[(CH3)2C=O]和1mol3,6-二羰基庚醛 ,则推测得[A]的结构式为
,则推测得[A]的结构式为

 .
.
(6)一定量的化学式均为C4H8的不饱和烃的混合气体,经臭氧分解后生成8.7g酮、0.45mol的醛(其中甲醛有0.21mol).试通过计算回答下列问题:
(a)氧化后生成哪些物质?写出结构简式
(b)混合气体中含哪几种烃(写结构简式)?其物质的量之比为多少?
查看习题详情和答案>>
①
 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(
,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基( ),这两步反应合在一起,称为“烯键的臭氧分解”.例如:
),这两步反应合在一起,称为“烯键的臭氧分解”.例如:

(1)写出异戊二烯臭氧分解的各种产物的结构简式
HCHO、

HCHO、
,它们的物质的量之比为
2:1
2:1
.(2)a mol某烃CnH2n-2(该分子中无-C≡C-)和
 结构),发生臭氧分解后,测得有机产物中含有羰基(
结构),发生臭氧分解后,测得有机产物中含有羰基( )b mol,则a和b的代数关系是:
)b mol,则a和b的代数关系是:b=4a
b=4a
或b=2a
b=2a
.(3)写出由环己醇(
 )和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
)和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式① 、
、
② 、
、
③ 、
、
④
 、
、②
 、
、③
 、
、④

① 、
、
② 、
、
③ 、
、
④
. 、
、②
 、
、③
 、
、④

(4)某烃A的化学式为C10H16,A经臭氧分解可得到等物质的量的两种产物,其结构简式分别为HCHO和
 .A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
.A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A



(5)从香精油中分离到一种化合物[A](C10H16),1mol[A]在催化加氢时可吸收2mol氢气;1mol[A]经臭氧氧化反应再加锌粉水解可得到1mol丙酮[(CH3)2C=O]和1mol3,6-二羰基庚醛
 ,则推测得[A]的结构式为
,则推测得[A]的结构式为 

(6)一定量的化学式均为C4H8的不饱和烃的混合气体,经臭氧分解后生成8.7g酮、0.45mol的醛(其中甲醛有0.21mol).试通过计算回答下列问题:
(a)氧化后生成哪些物质?写出结构简式
CH3CH2CHO、CH3CHO、HCHO、(CH3)2CO
CH3CH2CHO、CH3CHO、HCHO、(CH3)2CO
.(b)混合气体中含哪几种烃(写结构简式)?其物质的量之比为多少?
(CH3)2C=CH2、CH3CH2CH=CH2、CH3CH=CHCH3
(CH3)2C=CH2、CH3CH2CH=CH2、CH3CH=CHCH3
,5:2:3
5:2:3
.
实验室制取乙烯时,常伴有少量SO2等杂质气体生成.现利用下图所示装置制取较纯净的乙烯,并检验乙烯的化学性质.
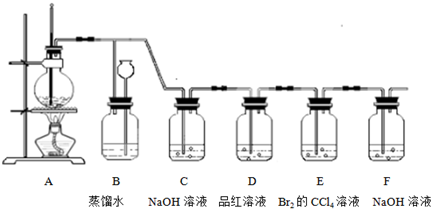
请回答:
(1)实验室制取乙烯的化学方程式为 .
(2)装置B可检验后续装置中是否发生堵塞.若发生堵塞,则B中的现象为 .
(3)装置C、D中所盛试剂的作用依次是 .
(4)根据装置E中的实验现象,可以说明乙烯是否具有不饱和性.下列反应能说明乙烯具有不饱和性的是 (填序号).
①水解反应 ②加成反应 ③加聚反应 ④消去反应 ⑤酯化反应. 查看习题详情和答案>>

请回答:
(1)实验室制取乙烯的化学方程式为
(2)装置B可检验后续装置中是否发生堵塞.若发生堵塞,则B中的现象为
(3)装置C、D中所盛试剂的作用依次是
(4)根据装置E中的实验现象,可以说明乙烯是否具有不饱和性.下列反应能说明乙烯具有不饱和性的是
①水解反应 ②加成反应 ③加聚反应 ④消去反应 ⑤酯化反应. 查看习题详情和答案>>
(2013?广安模拟)已知:

①如图1,在稀碱溶液中,溴苯难发生水解
②如图2,现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上的一溴代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应.
请回答下列问题:
(1)X中官能的名称是
(2)F→H的反应类型是
(3)I的结构简式为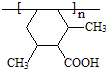
 ;
;
(4)E不具有的化学性质
a.取代反应 b.消去反应 c.氧化反应 d.1molE最多能与2molNaHCO3反应
(5)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:
 ;
;
②F→G的化学方程式:
 ;
;
(6)同时符合下列条件的E的同分异构体共有
 .
.
a.苯环上核磁共振氢谱有两种 b.不能发生水解反应
c.遇FeCl3溶液不显色 d.1molE最多能分别与1molNaOH和2molNa反应.
查看习题详情和答案>>

①如图1,在稀碱溶液中,溴苯难发生水解
②如图2,现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上的一溴代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应.
请回答下列问题:
(1)X中官能的名称是
酯基和溴原子
酯基和溴原子
.(2)F→H的反应类型是
消去
消去
.(3)I的结构简式为


(4)E不具有的化学性质
bd
bd
(选填序号)a.取代反应 b.消去反应 c.氧化反应 d.1molE最多能与2molNaHCO3反应
(5)写出下列反应的化学方程式:
①X与足量稀NaOH溶液共热的化学方程式:


②F→G的化学方程式:


(6)同时符合下列条件的E的同分异构体共有
4
4
种,其中一种的结构简式为

a.苯环上核磁共振氢谱有两种 b.不能发生水解反应
c.遇FeCl3溶液不显色 d.1molE最多能分别与1molNaOH和2molNa反应.