网址:http://m.1010jiajiao.com/timu3_id_351930[举报]

(1)在粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:
a.盐酸 b.氯化钡溶液 c.氢氧化钠溶液 d.碳酸钠溶液,则加入试剂的顺序是_______(填编号).
(2)Mg(OH)2中加入盐酸后,要获得MgCl2·6H2O晶体,需要进行的实验操作依次为______.
a.蒸馏 b.灼烧 .过滤 d.蒸发 e.冷却结晶
(3)利用MgCl2·6H2O可制得无水氯化镁,应采取的措施是__________________.
(4)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是____.
a.精制饱和食盐水进入阳极室
b.纯水(加少量NaOH)进入阴极室
c.阴极产物为氢氧化钠和氢气
d.阳极的电极反应为:Cl2+2e-===2Cl-
(5)母液中常含有MgCl2、NaCl、MgSO4、KCl等(其溶解度与温度的关系如图所示),可进一步加工制得一些重要的产品.若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是________;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的________晶体.

某研究性学习小组为了研究Cu与浓H2SO4的反应和比较Cu的+1价化合物与+2价化合物的稳定性,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端投入浓H2SO4中,另一端露置在液面上方.
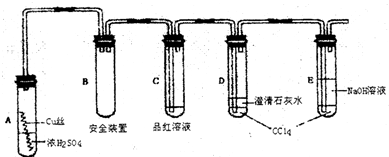
以下是该学习小组部分交流记录及后续探究实验的记录.
材料一:小组交流记录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4.
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S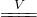 Cu2S(黑色)
Cu2S(黑色)
材料二、探究实验剪辑
实验1:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化.
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸、黑色明显变浅,溶液呈蓝绿色.
实验3:将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减小10%左右.
根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是;______;D、E两支试管中CCl4
的作用是______.
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失.写出淡黄色固体消失的化学反应方程式:______.
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀.学生1猜想是由于SO2溶解度较大,生成了Ca(SHO3)2的缘故.请你设计实验验证学生1的猜想______.
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是:______.(写化学式)
(5)学生2将反应后的反应液稀释后进行检验,发现溶液呈酸性,对比,学生2提出猜想是:铜与浓硫酸反应生成的硫酸铜水解使溶液呈酸性,请写出该水解反应的离子方程式:______.
你的猜想是:______;
请你设计一个简单的实验以验证你的猜想:______.
(6)该研究性学习小组的同学为了比较Cu的+1价化合物和+2价化合物的稳定性,他们取98gCu(OH)2固体,加热至80℃-100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末X.冷却后称量,X的质量为72g.向X中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,据此可推得,X的化学式为______,可以得出的结论是
______.
查看习题详情和答案>>
下列有关化学实验的基本摄作或物质分离提纯的方法正确的是________(填序号).
①由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来;
②水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精;
③用玻璃棒蘸取待测液后.点在用蒸馏水润湿的pH试纸上.观察颜色变化并与标准比色卡比较测得该溶液的pH
④用排饱和食盐水的方法收集氯气可除去氯气中混有的少量氯化氢气体;
⑤配制一定物质的量浓度的溶液时.用蒸馏水把容量瓶洗涤干净后.不经干燥直接使用;
⑥除去FeC13溶液中混有的少量FeC12:加入适量的氯水.
⑦硫酸铜晶体生结晶水含量的测定实验中.加热后所得的固体在空气中冷却后称量,会引起实验结果偏大.
| 温度℃ | FeSO4?7H2O | (NH4)2SO4 | |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78,0 | 28.1 |
实验步骤流程图:
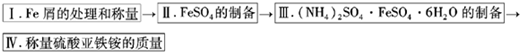
请完成以下实验记录:
(1)步骤I中处理铁屑所用试剂为
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全).趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中.将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入
(4)称量生成的硫酸亚铁铵的质量,理论上为
(6分)硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体。三种盐的溶解度(单位为g/l00gH2O)见下表:
实验用品:10% Na2CO3溶液、Fe屑、3mol/LH2SO4、(NH4)2SO4、蒸馏水、无水乙醇。
实验步骤流程图:
请完成以下实验记录:
(1)步骤I中处理铁屑所用试剂为________________,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______ g(用含m1和m2的代数式表示,要求化简,下同。)水配制成室温下( 20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体,过滤后用________________洗涤晶体。
(4)称量生成的硫酸亚铁铵的质量,理论上为________________g。
查看习题详情和答案>>