网址:http://m.1010jiajiao.com/timu3_id_351892[举报]
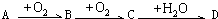 .以下推断不正确的是( )
.以下推断不正确的是( )| A、若A为溶于CS2的淡黄色固体单质,且D为强酸,则B通常用品红试剂来检验 | B、若A为喷泉实验常用的气体且其水溶液呈碱性,则D能与A反应制化肥 | C、若C为温室气体,则A与C在一定条件下反应可生成B | D、若B、C对环境造成的危害主要是光化学烟雾等,则A不可能是单质 |
下列现象可以用“相似相溶原理”解释的是
[ ]
A.氧化铝不溶于水,但可溶于NaOH溶液
B.硫磺不溶于水,但可溶于CS2
C.硫酸钡不溶于水,也不溶于稀HNO3
D.碘晶体难溶于水,易溶于酒精和CCl4
查看习题详情和答案>>自然界中的水要经过消毒杀菌才可成为生活饮用水。ClO2是一种高效安全灭菌消毒剂,
其中Cl化合价为 价。
价。
(1)氯原子最外层有 种能量不同的电子,某化合物中O的化合价与ClO2中O的化合价恰好相反,写出该化合物的分子式 。
(2)下列可用作比较S和C非金属性强弱依据的是
A.CS2中各元素的化合价 B.气态氢化物的稳定性
C.元素在周期表中的位置 D.最高价含氧酸的酸性
(3)以下性质的比较正确的是
A.键长:HF>HCl B.稳定性:HF>HCl
C.酸性:HF>HCl D.沸点:HF>HCl
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3 O2
+[O]-Q 平衡常数为K1 ;
O2
+[O]-Q 平衡常数为K1 ;
反应② [O]+O3 2O2+Q 平衡常数为K2 ;
2O2+Q 平衡常数为K2 ;
总反应:2O3 3O2+Q 平衡常数为K。
3O2+Q 平衡常数为K。
(4)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
|
pH t / min T / ℃ |
3.0 |
4.0 |
5.0 |
6.0 |
|
20 |
301 |
231 |
169 |
58 |
|
30 |
158 |
108 |
48 |
15 |
|
50 |
31 |
26 |
15 |
7 |
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(5)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A.40°C、pH=3.0 B.10°C、pH=4.0 C.30°C、pH=7.0
(6)下列叙述正确的是
A.降低温度,K增大 B.K=K1+K2
C.适当升温,可提高消毒效率 D.压强增大,K2减小
查看习题详情和答案>>
X、Y、Z、W原子序数依次增大的4种短周期元素,已知:
①X与Z、Y与W分别同族;
②X、Z、W分别与Y都可组成两种中学常见的化合物;
③Y的阴离子与Z的阳离子的核外电子排布相同;
④这4种元素的单质中有一种易溶于CS2溶剂。
(1)写出由Y与Z两元素形成化合物Z2Y2的电子式 。其化学键类型有__________ 。
(2)写出2种均由这4种元素所组成的化合物在水溶液中发生反应的化学方程式______________。
(3)用X、Y两元素的单质可制成已在阿波罗飞船中使用的新型电源,其结构如下图所示。两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出在电极表面放电。
 |
①a是电源的_____________极,电极反应式是______________________________;
②b电极上的电极反应式是___________________________。
查看习题详情和答案>>X、Y、Z、W、V为前四周期常见的五种元素,其中四种为短周期元素.X原子核外电子数等于其电子层数;常温常压下,Y单质固体难溶于水而易溶于CS2;Z的氢化物在水中可完全电离出氢离子;W原子的电子层数是其价电子数的3倍;V的单质是一种应用最为广泛的金属.
请回答下列问题:
(1)写出实验室通过加热制备z单质的离子方程式________;
(2)W的两种常见氧化物中阳离子和阴离子个数比为2∶1的是________(写化学式);
(3)写出X、Y、W三种元素组成的化合物的水溶液与Z单质反应的离子方程式________(可不配平);
(4)检验V的最高价简单离子常用的试剂是________;
(5)将12 g Y单质完全燃烧的产物通入100 mL 1.2 mol·L-1的氢氧化钠溶液中,所得溶液中含有的主要离子分别是________.