网址:http://m.1010jiajiao.com/timu3_id_351889[举报]
下表中,对陈述I、1I的正确性及两者问是否具有因果关系的判断都正确的是
选项 | 陈述I | 陈述lI | 判断 |
A. | CO2和SiO2都是酸性氧化物 | CO2和SiO2都可以与水反应生成酸 | I对;Ⅱ对;有 |
B. | Cl2和SO2混合后可用于漂白纸浆 | C12和SO4都有较好的漂白作用 | I对;Ⅱ错;无 |
C. | 铜绿的主要成分是碱式碳酸铜[Cu2 (OH)2CO3] | 可用稀盐酸除铜器表面的铜绿 | I对;Ⅱ对;有 |
D. | 镁条在空气中燃烧生成的氧化物是MgO | 钠在空气中燃烧生成的氧化物是Na2O | I对;Ⅱ对;无 |
| A、工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 | B、氮的氧化物是形成光化学烟雾的主要物质,硫的氧化物是形成酸雨的主要物质 | C、NO2、CO2和SO2溶于水均可导电,它们都是电解质 | D、将SO2通入酸化的Ba(NO3)2溶液中会出现白色沉淀 |
【实验原理】
利用碳酸盐和亚硫酸盐分别与酸反应可以生成CO2和SO2,然后让两种气体直接与品红溶液作用.
【实验装置】
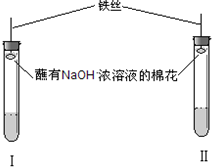
【实验操作和现象】
| 实验操作 | 实验现象 | 探究结论 |
| A.取少量品红溶液加入试管Ⅰ中,加入适量碳酸钠溶液,充分混合后再加入一定量的稀硫酸,并立即塞上塞子 | 溶液的红色逐渐褪去,加稀硫酸后溶液逐渐变红色 | CO2 |
| B.取少量品红溶液加入试管Ⅱ中,加入适量亚硫酸钠溶液,充分混合后再加入一定量的稀硫酸,并立即塞上塞子 | 溶液的红色逐渐褪去,加稀硫酸后溶液逐渐变红,随着反应的进行,颜色又逐渐消失 | SO2 |
②该实验装置中胶塞上都附着蘸有浓NaOH溶液的棉花,其作用是:
【问题探究】
他们推测品红可能是一种酸碱指示剂
①你认为他们推测的依据是
②请你帮助他们设计实验验证上述推测.实验方案:
【问题延伸】
某同学将SO2通入酸性高锰酸钾溶液,溶液紫色褪去.他认为该现象表现出SO2的漂白性,你认为正确吗?若不正确,请回答原因;若正确,此空不答
已知:SrSO4(s)?Sr2+(aq)+SO2-4(aq) KSP=2.5×10-7
SrSO3(s)?Sr2+(aq)+CO2-4(aq) KSP=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为
(2)对于上述反应,实验证明增大CO2-3的浓度或降低温度都有利于提高SrSO4的转化率.判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将
②增大CO2-3的浓度,平衡常数K将
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3.实验所用试剂为
(4)BaCl2溶液和Ba(NO3)2溶液是实验中检验SO2-4的常用试剂.某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4.你认为该推理是否严密?试说明理由.
(14分)钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s)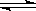 Sr2+(aq)+SO2-4(aq)KSP=2.5×10-7
Sr2+(aq)+SO2-4(aq)KSP=2.5×10-7
SrSO3(s)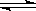 Sr2+(aq)+CO2-4(aq)KSP=2.5×10-9
Sr2+(aq)+CO2-4(aq)KSP=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为 ,该反应的平衡常数表达式为 ;该反应能发生的原因是 。(用沉淀溶解再平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO2-3的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将 ;
②增大CO2-3的浓度,平衡常数K将 。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用试剂为 ;实验现象及其相应结论 。
(4)BaCl2溶液和Ba(NO3)2溶液是实验中检验SO2-4的常用试剂。某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4。
你认为该推理是否严密?试说明理由。
查看习题详情和答案>>