摘要:四种溶液A.B.C.D它们分别是H2SO4.Na2CO3.Na2SO3.BaCl2溶液中的某种为鉴别它们.现作如下实验: A+B 白色沉淀+无色溶液,A+C 无色气体,A+D 无明显现象, B+D 白色沉淀+无色溶液,A+ Na2S 无明显现象,A+C+Na2S溶液 浑浊 (1)写出化学式:A B C D (2)写出化学方程式①A+C ②A+Na2S+C
网址:http://m.1010jiajiao.com/timu3_id_351790[举报]
 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A与C,B与D分别是同主族元素;已知B、D二元素原子核中质子数之和是A、C二元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体.请回答以下问题:(1)写出由A、B两元素形成的原子个数比为1:1的化合物的化学式
H2O2
H2O2
,此化合物能使酸性KMnO4溶液退色,体现该化合物具有还原性
还原性
性.(2)D元素在元素周期表中的位置
第三周期第ⅥA族
第三周期第ⅥA族
,B和C两元素形成的原子个数比为1:1的化合物中含有的化学键的类型为离子键、共价键
离子键、共价键
.(3)A、B、C、D四种原子半径由大到小为
Na>S>O>H
Na>S>O>H
(填元素符号);四种离子半径由大到小为S2->O2->Na+>H+
S2->O2->Na+>H+
(填离子符号).(4)写出由A、B两元素形成的原子个数比为2:1的化合物与B、C两元素形成的原子个数比为1:1的化合物反应的离子方程式
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.(5)两种物质均由A、B、C、D四种元素组成,写出它们在水溶液中反应的离子方程式
HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
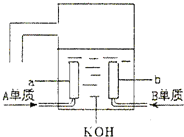
.(6)用A元素的单质与B元素的单质可制成新型的化学电源,已在宇宙飞船中使用.其构造如图所示.两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.则a是
负
负
极,电极反应式为4H2-4e-=4H+
4H2-4e-=4H+
,b是正
正
极,电极反应式为O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料.它们的结构简式如图1所示:

请回答下列问题:
(1)用A、B、C、D填空:①能发生银镜反应的有
(2).按图2C经一步反应可生成E,E是B的同分异构体,则反应①属于
 .
.
(3)同时符合下列两项要求的D的同分异构体有4种:
①化合物是1,2-二取代苯;②苯环上的两个取代基分别为羟基和含有-COO-结构的基团.其中两种(G和H)结构简式如图3所示,请写出另外两种异构体
 .
.
查看习题详情和答案>>

请回答下列问题:
(1)用A、B、C、D填空:①能发生银镜反应的有
A、C
A、C
.②既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有D
D
.(2).按图2C经一步反应可生成E,E是B的同分异构体,则反应①属于
氧化
氧化
反应(填反应类型名)写出反应②的化学方程式:

(3)同时符合下列两项要求的D的同分异构体有4种:
①化合物是1,2-二取代苯;②苯环上的两个取代基分别为羟基和含有-COO-结构的基团.其中两种(G和H)结构简式如图3所示,请写出另外两种异构体


A、B、C、D、E是五种常见的短周期主族元素,它们的原子序数依次增大,其中A与C、B与D分别同族,已知B、D两种元素原子核中质子数之和是A、C两种元素原子核中质子数的2倍,五种元素中只有一种为金属元素.请回答下列问题
(1)物质甲、乙是由上述五种元素中的两种元素形成的常温下为液体的化合物,则甲、乙的化学式
(2)已知:2DB2+B2 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
(3)丙、丁两化合物均由A、B、C、D四种元素组成,写出丙丁两化合物反应的化学反应方程式:
(4)将一定量的DB2通入到紫色石蕊试液中的现象是:
(5)用A、B两元素的单质可制成新型化学电源,若以C的最高价氧化物的水化物为电解质,则通A的一极的电极反应方程式:
查看习题详情和答案>>
(1)物质甲、乙是由上述五种元素中的两种元素形成的常温下为液体的化合物,则甲、乙的化学式
H2O或H2O2
H2O或H2O2
、H2O2或H2O
H2O2或H2O
,写出其中一种物质使酸性KMnO4溶液褪色的离子反应方程式5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑
5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑
.(2)已知:2DB2+B2
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热(30a+1.5b)
(30a+1.5b)
kJ(用a、b表示),我国工业生成DB2所用的原料是FeS2
FeS2
(填化学式)(3)丙、丁两化合物均由A、B、C、D四种元素组成,写出丙丁两化合物反应的化学反应方程式:
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
.(4)将一定量的DB2通入到紫色石蕊试液中的现象是:
溶液变为红色
溶液变为红色
.再通入等物质的量E2所观察的现象是溶液仍为红色
溶液仍为红色
.(5)用A、B两元素的单质可制成新型化学电源,若以C的最高价氧化物的水化物为电解质,则通A的一极的电极反应方程式:
H2+2OH--2e-→2H2O
H2+2OH--2e-→2H2O
.若以此电源进行铁片上镀铜,若两极质量差为6.4g时,理论上消耗标况下1.12
1.12
L的A单质.A、B、C、D四种可溶性离子化合物,其组成中的阴阳离子各不相同.它们在溶液中电离的阴阳离子分别为:Cl-、SO42-、NO3-、OH-、Ag+、Na+、Mg2+、Cu2+.当四种物质相互反应时,有如下现象:①A+B 产生白色沉淀 ②B+D 产生白色沉淀 ③C+D 产生蓝色沉淀
(1)A、B、C、D的化学式分别为:A
(2)写出发生反应的化学方程式:A+B
查看习题详情和答案>>
(1)A、B、C、D的化学式分别为:A
AgNO3
AgNO3
BMgCl2
MgCl2
CCuSO4
CuSO4
DNaOH
NaOH
(2)写出发生反应的化学方程式:A+B
AgNO3+NaCl=AgCl↓+NaNO3
AgNO3+NaCl=AgCl↓+NaNO3
B+DMgCl2+2NaOH=Mg(OH)2↓+2NaCl
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
C+DCuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
. ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:
ⅠA、B、C、D四种元素在周期表中分别处于元素X的四周(如图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的.试确定:(1)各元素的符号:
A:
Si
Si
,B:N
N
,C:S
S
,D:As
As
,X:P
P
.(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:
H2SO4>H3PO4>H3AsO4
H2SO4>H3PO4>H3AsO4
.(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:
NH3>PH3>SiH4
NH3>PH3>SiH4
.ⅡFe3+和I-在水溶液中的反应如下:2I-+2Fe3+?2Fe2++I2(水溶液),
(1)该反应的平衡常数K的表达式为:K=
| c2(Fe2+)×c(I2) |
| c2(I-)×c2(Fe3+) |
| c2(Fe2+)×c(I2) |
| c2(I-)×c2(Fe3+) |
[物质的浓度用“c(物质)”表示].当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡
向右
向右
移动(填“向右”、“向左”、“不”).(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K[c(I-)]m[c(Fe3+)]n(其中K为常数)
| c(I-)(mol/L) | c(Fe3+)(mol/L) | v[mol/(L?s)] | |
| (1) | 0.20 | 0.80 | 0.032K |
| (2) | 0.60 | 0.40 | 0.144K |
| (3) | 0.80 | 0.20 | 0.128K |
①在v=K[c(I-)]m[c(Fe3+)]n中,m、n的值为
C
C
.A.m=1、n=1 B.m=1、n=2 C.m=2、n=1 D.m=2、n=2
②I-浓度对反应速率的影响
>
>
Fe3+浓度对反应速率的影响(填“>”、“<”或“=”).