摘要:卤族元素--典型的非金属 (1)以氯为例.了解卤族元素的物理性质和化学性质. (2)从原子的核外电子排布.理解卤族元素的相似性和递变性. (3)以氯化氢为例.了解卤化氢的性质和用途. (4)掌握盐酸的制备.性质.用途. (5)了解氯化钠等重要的金属卤化物的性质和用途. 的重要性和用途.漂白粉的组成.性质和用途.
网址:http://m.1010jiajiao.com/timu3_id_351522[举报]
某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金
属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非
金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规
律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已
知常温下浓盐酸与高锰酸钾能反应生成氯气。

(1)甲同学设计实验的依据是_____________________________________________;
写出选用物质的名称: A____________,B__________,C____________;
(2)乙同学的实验原理是____________________________________________;
写出A和B处的离子方程式:A处:
B处: ___________________________________________________。
B处的现象 ; C处的现象
查看习题详情和答案>>A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族.A、C能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1.B元素基态原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素.根据以上信息回答下列问题:
(1)D元素的名称为
(2)C、D、F的简单离子中,半径最小的是
(3)BA4的空间构型为
(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
(5)下列关于甲和乙的说法中,错误的是
①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零.
查看习题详情和答案>>
(1)D元素的名称为
氟
氟
,E的电子排布式为ls22s22p63s1
ls22s22p63s1
;(2)C、D、F的简单离子中,半径最小的是
Al3+
Al3+
(填离子符号);(3)BA4的空间构型为
正四面体
正四面体
,B、C两元素形成的非极性分子的结构式为O=C=O
O=C=O
;(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
,可以相互反应生成O2的化学方程式为2Na2O2+CO2═2Na2CO3+O2
2Na2O2+CO2═2Na2CO3+O2
;(5)下列关于甲和乙的说法中,错误的是
①③⑤
①③⑤
(填序号)①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零.
A、B、C、D、E五种短周期元素,核电荷数依次增加,其中A与D同族,C与E同族.A的一种原子内无中子,B原子最外层电子数是内层电子数的2倍,一个C2-离子含10个电子.
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式: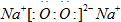
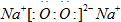 .
.
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式: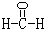
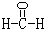 .
.
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:
(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是
(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:
查看习题详情和答案>>
(1)D与C形成一种含有两种化学键的离子化合物,写出该离子化合物的电子式:
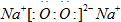
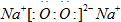
(2)甲是由A、B、C三种元素组成的相对分子质量最小的物质,且可以发生银镜反应,请写出甲的结构式:
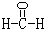
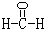
(3)由A、B两种元素组成的非极性分子有多种,其中一个分子含4个原子的为乙,已知乙的燃烧热为1300kJ/mol,乙燃烧的热化学反应方程式是:
C2H2(g)+
O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol
| 1 |
| 2 |
C2H2(g)+
O2(g)=2CO2(g)+H2O(1)△H=-1300kJ/mol
.| 1 |
| 2 |
如果用乙与C的单质在KOH作电解质溶液的条件下构成燃料电池,请写出其负极的电极反应式为:
C2H2-10e-+14OH-=2CO32-+8H2O
C2H2-10e-+14OH-=2CO32-+8H2O
(4)均由A、C、D、E四种元素组成的两种物质丙和丁在溶液中反应的离子方程式是:
H++HSO3-=H2O+SO2↑
H++HSO3-=H2O+SO2↑
.(5)A与C形成一种物质戊,在酸性条件下,将少量戊加入淀粉KI溶液后,溶液显蓝色,反应的离子方程式是
2I-+H2O2+2H+=I2+2H2O
2I-+H2O2+2H+=I2+2H2O
.(6)E的一种氧化物与ClO-均具有漂白性,但两者混合后的产物均不具有漂白性,请写出该反应的离子方程式:
SO2+ClO-+H2O=SO42-+Cl-+2H+或SO2+ClO-+20H-=SO42-+Cl-+H2O
SO2+ClO-+H2O=SO42-+Cl-+2H+或SO2+ClO-+20H-=SO42-+Cl-+H2O
.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究,A、B、C三处分别是HNO3溶液、Na2CO3溶液、Na2SiO3溶液;乙同学设计了如图2装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
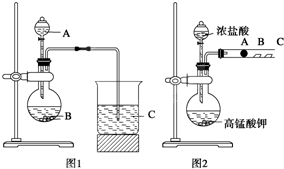
(1)写出甲同学(图1)仪器的名称:A ,B ,C_ ;
(2)图1中各反应的离子方程式分别为 ;
(3)写出乙同学设计的B处的离子方程式: .
(4)写出乙同学设计的C处的实验现象 .
查看习题详情和答案>>

(1)写出甲同学(图1)仪器的名称:A
(2)图1中各反应的离子方程式分别为
(3)写出乙同学设计的B处的离子方程式:
(4)写出乙同学设计的C处的实验现象
 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.已知常温下浓盐酸与高锰酸钾能反应生成氯气.(1)从以下所给物质中选出甲同学设计的实验所用到物质:图1中试剂A、B为(填序号)
①、④
①、④
;①稀硫酸溶液; ②浓盐酸; ③石灰石;④碳酸钠粉末;⑤Na2SO3溶液
写出图1烧瓶中发生反应的离子方程式
CaCO3+2H+=Ca2++CO2↑+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
;(2)甲同学所做实验图1烧杯中现象为
出现白色沉淀
出现白色沉淀
;(3)乙同学所做实验图2中B处的现象为
湿润的淀粉KI试纸变蓝
湿润的淀粉KI试纸变蓝
;(4)写出图2中A处发生反应的离子方程式:
Cl2+2Br-=Br2+2Cl-
Cl2+2Br-=Br2+2Cl-
.