网址:http://m.1010jiajiao.com/timu3_id_351098[举报]
①SO2、NO、NO2都是形成酸雨的因素,都能和水反应生成酸
②除去CO2中少量的SO2,将混合气体通过饱和Na2CO3溶液
③水晶的主要成分是SiO2
④SiO2与CO2都属于酸性氧化物,都不能与酸反应
⑤将CO2通入饱和Na2CO3溶液中有沉淀产生,继续通入CO2沉淀溶解
⑥某酸雨样本采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
⑦CO2不能与CaCl2溶液反应,SO2也不能与CaCl2溶液反应
⑧实验室可用NaOH溶液处理NO2和SO2废气
⑨用稀双氧水清洗伤口可以杀菌消毒
⑩NO只能用排水集气法收集,不能用排空气法收集;而NO2只能用排空气法收集,不能用排水集气法. 查看习题详情和答案>>
 (2013?江苏)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).
(2013?江苏)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.①铁粉的作用是
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3) 出发,先制备绿矾,再合成柠檬酸亚铁.请结合如图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4?7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,
或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤”
或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤”
(1)写出熔融时的主要成分与纯碱反应的化学方程式(Al2O3与纯碱反应和SiO2与纯碱的反应相似):__________,__________。
(2)最后沉淀物是____________________,生成该沉淀的离子方程式是___________________。
(3)实验中常用的有瓷坩埚、氧化铝坩埚和铁坩埚,本实验在熔融土样时,应选用__________坩埚。
查看习题详情和答案>>已知:BaSO4(s) + 4C(s) 4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。
4CO(g) + BaS(s)工业上以重晶石矿(主要成分BaSO4,杂质为Fe2O3、SiO2)为原料,通过下列流程生产氯化钡晶体(BaCl2·nH2O)。

回答下列问题:
(1)不溶物A的化学式是_________;若在实验室进行焙烧时,所产生的气体的处理方法是
a.用NaOH溶液吸收 b.用浓硫酸吸收 c.点燃
(2)用单位体积溶液中所含的溶质质量数来表示的浓度叫质量-体积浓度,可以用g/L表示,现用38%的浓盐酸配制含溶质109.5g/L的稀盐酸500mL,所需要的玻璃仪器除了玻璃棒还有 。
(3)沉淀反应中所加的试剂R可以是下列试剂中的
a.NaOH溶液 b.BaO固体 c.氨水 d.生石灰
证明沉淀已经完全的方法是________________________________________________________。
(4)设计一个实验确定产品氯化钡晶体(BaCl2·nH2O)中的n值,完善下列实验步骤:
①称量样品②_______ ③置于_________(填仪器名称)中冷却 ④称量 ⑤恒重操作。
恒重操作是指____________________________________________ _;
第③步物品之所以放在该仪器中进行实验的原因是 。
(5)将重晶石矿与碳以及氯化钙共同焙烧,可以直接得到氯化钡,该反应的化学方程为
BaSO4+ 4C+CaCl2 4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
4CO + CaS+ BaCl2。请你完善下列从焙烧后的固体中分离得到氯化钡晶体的实验流程的设计(已知硫化钙不溶于水,易溶于盐酸)。
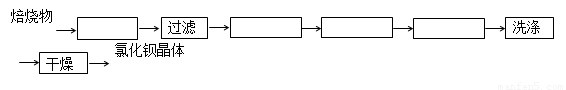
(方框内填写操作名称)
查看习题详情和答案>>