摘要:氧化还原反应的概念,氧化性还原性相对强弱的判断.氧化还原反应的规律及其应用.
网址:http://m.1010jiajiao.com/timu3_id_350949[举报]
关于一些重要的化学概念有下列说法:
①明矾晶体是混合物;
②BaSO4是一种难溶于水的电解质;
③硫酸、纯碱、小苏打分别属于酸、碱、盐;
④氧化还原反应都属于离子反应;
⑤酸雨是指pH小于7.0的降水;
⑥摩尔是国际科学界建议采用的七种基本物理量之一;
⑦丁达尔效应可以区分溶液和胶体;
⑧酸性氧化物:H2O、NO2、CO、N2O5;
其中正确的是( )
①明矾晶体是混合物;
②BaSO4是一种难溶于水的电解质;
③硫酸、纯碱、小苏打分别属于酸、碱、盐;
④氧化还原反应都属于离子反应;
⑤酸雨是指pH小于7.0的降水;
⑥摩尔是国际科学界建议采用的七种基本物理量之一;
⑦丁达尔效应可以区分溶液和胶体;
⑧酸性氧化物:H2O、NO2、CO、N2O5;
其中正确的是( )
查看习题详情和答案>>
关于一些重要的化学概念有下列说法:
①明矾晶体是混合物;
②BaSO4是一种难溶于水的电解质;
③硫酸、纯碱、小苏打分别属于酸、碱、盐;
④氧化还原反应都属于离子反应;
⑤酸雨是指pH小于7.0的降水;
⑥摩尔是国际科学界建议采用的七种基本物理量之一;
⑦丁达尔效应可以区分溶液和胶体;
⑧酸性氧化物:H2O、NO2、CO、N2O5;
其中正确的是( )
查看习题详情和答案>>
①明矾晶体是混合物;
②BaSO4是一种难溶于水的电解质;
③硫酸、纯碱、小苏打分别属于酸、碱、盐;
④氧化还原反应都属于离子反应;
⑤酸雨是指pH小于7.0的降水;
⑥摩尔是国际科学界建议采用的七种基本物理量之一;
⑦丁达尔效应可以区分溶液和胶体;
⑧酸性氧化物:H2O、NO2、CO、N2O5;
其中正确的是( )
| A.①② | B.②⑦ | C.③④ | D.④⑤ |
关于一些重要的化学概念有下列说法:
①明矾晶体是混合物;
②BaSO4是一种难溶于水的电解质;
③硫酸、纯碱、小苏打分别属于酸、碱、盐;
④氧化还原反应都属于离子反应;
⑤酸雨是指pH小于7.0的降水;
⑥摩尔是国际科学界建议采用的七种基本物理量之一;
⑦丁达尔效应可以区分溶液和胶体;
⑧酸性氧化物:H2O、NO2、CO、N2O5;
其中正确的是( )
A.①②
B.②⑦
C.③④
D.④⑤
查看习题详情和答案>>
①明矾晶体是混合物;
②BaSO4是一种难溶于水的电解质;
③硫酸、纯碱、小苏打分别属于酸、碱、盐;
④氧化还原反应都属于离子反应;
⑤酸雨是指pH小于7.0的降水;
⑥摩尔是国际科学界建议采用的七种基本物理量之一;
⑦丁达尔效应可以区分溶液和胶体;
⑧酸性氧化物:H2O、NO2、CO、N2O5;
其中正确的是( )
A.①②
B.②⑦
C.③④
D.④⑤
查看习题详情和答案>>
关于一些重要的化学概念有下列说法:
①明矾晶体是混合物;
②BaSO4是一种难溶于水的电解质;
③硫酸、纯碱、小苏打分别属于酸、碱、盐;
④氧化还原反应都属于离子反应;
⑤酸雨是指pH小于7.0的降水;
⑥摩尔是国际科学界建议采用的七种基本物理量之一;
⑦丁达尔效应可以区分溶液和胶体;
⑧酸性氧化物:H2O、NO2、CO、N2O5;
其中正确的是
- A.①②
- B.②⑦
- C.③④
- D.④⑤
目前,化学已发展成一门博大精深、内涵丰富的自然科学,“化学发现”是推动化学学科发展的动力和源泉。请回答下列问题:
(1)英国化学家卢瑟福和他的学生丹麦物理学家玻尔建立了原子结构模型。
①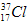 的中子数为______,该氯原子与
的中子数为______,该氯原子与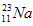 原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
②O2-的结构示意图为_____,沸点H2O_____H2S(填“”)。
(2)1799年,意大利物理学家伏特制成了世界上第一个电池--“伏打”电池,直接促进了人类文明的发展。下列①~⑤装置中,能构成原电池的是_______(填序号),其正极反应式为______,负极反应式为_________________,电子向______ (填“正极”或“负极”,下同)运动,SO42-向______运动。
(1)英国化学家卢瑟福和他的学生丹麦物理学家玻尔建立了原子结构模型。
①
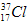 的中子数为______,该氯原子与
的中子数为______,该氯原子与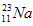 原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。②O2-的结构示意图为_____,沸点H2O_____H2S(填“”)。
(2)1799年,意大利物理学家伏特制成了世界上第一个电池--“伏打”电池,直接促进了人类文明的发展。下列①~⑤装置中,能构成原电池的是_______(填序号),其正极反应式为______,负极反应式为_________________,电子向______ (填“正极”或“负极”,下同)运动,SO42-向______运动。
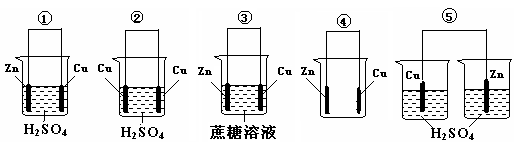
(3)1871年,俄国化学家门捷列夫不但发现了元素周期律,还科学地预言了一些新元素的存在,如“类铝”元素镓(元素符号:Ga)位于第四周期。
① 镓的族序数是______,镓的最高价氧化物与盐酸反应的离子方程式是____________。
② 下表是短周期中部分元素的原子半径及主要化合价。
① 镓的族序数是______,镓的最高价氧化物与盐酸反应的离子方程式是____________。
② 下表是短周期中部分元素的原子半径及主要化合价。
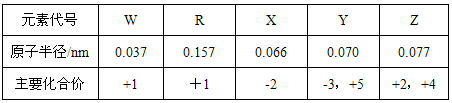
ⅰ:X、Y、Z三种元素的非金属性的强弱顺序为____________(用元素符号和“>” 表示)。
ⅱ:W、X、Y按原子个数比为4:3:2组成一种离子化合物,化学式为______。
ⅲ:R2X2的电子式为______,R2X2中化学键的类型是______,R2X2与W2X反应的离子方程式为________________________,若反应中转移的电子数为0.4×6.02×1023,则参加反应的R2X2的质量为______g。
(4)合成氨是人类科学技术发展史上的一项重大突破。德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖。
① 工业合成氨反应的化学方程式为__________________。
② 化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差。依据下表计算:
ⅱ:W、X、Y按原子个数比为4:3:2组成一种离子化合物,化学式为______。
ⅲ:R2X2的电子式为______,R2X2中化学键的类型是______,R2X2与W2X反应的离子方程式为________________________,若反应中转移的电子数为0.4×6.02×1023,则参加反应的R2X2的质量为______g。
(4)合成氨是人类科学技术发展史上的一项重大突破。德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖。
① 工业合成氨反应的化学方程式为__________________。
② 化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差。依据下表计算:
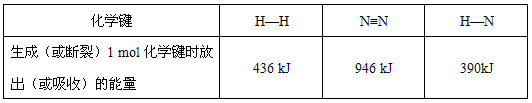
工业合成氨的反应是______ (填“放热”或“吸热”)反应,1molN2完全反应时对应热量的数值为______ kJ。
(5)德意志化学家施塔尔、法国化学家拉瓦锡等人在氧化还原反应概念的形成中做出重要贡献。在某一氧化还原反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是产物之一。
① 该反应中的还原剂是______ ;该反应中的还原产物是______。
② 写出该反应的化学方程式并用单线桥标出电子转移的方向和数目____________。
查看习题详情和答案>>
(5)德意志化学家施塔尔、法国化学家拉瓦锡等人在氧化还原反应概念的形成中做出重要贡献。在某一氧化还原反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是产物之一。
① 该反应中的还原剂是______ ;该反应中的还原产物是______。
② 写出该反应的化学方程式并用单线桥标出电子转移的方向和数目____________。