网址:http://m.1010jiajiao.com/timu3_id_350684[举报]
阿斯匹林(aspirin)的有效成分是乙酰水杨酸,它是19世纪末合成成功的,作为一种有效的解热镇痛、治疗感冒的药物,至今仍广使用.有关报道表明,人们正在发现它的某些新功能.阿斯匹林是由水杨酸(邻-羟基苯甲酸)与乙酸酐进行酯化反应而得的.

(1)阿斯匹林的分子式为
(2)水杨酸不能发生的反应类型有
A、银镜反应 B、中和反应 C、酯化反应 D、水解反应
(3)如果过量服用阿斯匹林会出现水杨酸反应,要停药并静脉滴注
(4)乙酰水杨酸能在稀酸或碱溶液中水解.写出乙酰水杨酸与过量NaOH溶液共热的化学方程式:


(5)写出同时满足下列四个要求的水杨酸的一种同分异构体:


①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1mol该同分异构体能与2molNaOH发生反应;
④苯环上的一氯代物只有两种.
(6)已知酚遇FeCl3溶液显紫色,但显色反应要在中性或弱酸性溶液中进行.现要求用已有的知识检验出乙酰水杨酸分子中存在酯基.有人设计了如下的实验方案:
取一支洁净的试管,向其中加入2mL阿斯匹林溶液,然后再滴入2滴稀硫酸,将溶液在酒精灯上加热片刻后,滴入2滴FeCl3溶液,振荡,无明显现象;再向其中逐滴加入Na2CO3溶液,振荡,出现了紫色.你认为逐滴加入Na2CO3溶液的目的是
从此实验你得到的启示有
有a、b、c、d、e五种元素,其原子序数依次增大。
已知:①前四种元素处于短周期,在周期表中,a与b相邻,b与c相邻,c与d相邻,且b、c、d三种元素原子的最外层电子数之和为19。
②e是一种过渡元素,其单质是用量最大,应用最广泛的金属。
请回答:
(1)前四种元素的最高价氧化物对应水化物中酸性最强的是 (写化学式)
(2)前四种元素的氢化物的水溶液中,不能使湿润的蓝色石蕊试纸变红的有 (写化学式)
(3)c、d两元素组成的一种化合物,各原子的最外层都满足8电子稳定结构,写出这种化合物的电子式 。
(4)将ed3溶液滴入沸水中可得到红褐色液体,此液体不具有的性质是 (填写字母)
A.光束通过液体时形成光亮的“通路”
B.插入电极通直流电后,有一极附近液体颜色加深
C.向该液体中加入AgNO3溶液,不产生沉淀
D.将该液体加热蒸干灼烧后,有氧化物生成
(5)c单质在空气中燃烧生成一种元色气体。该气体与含1.5mold元素的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,有1.5×6.02×1023个电子转移,则该反应的化学方程式是 。
查看习题详情和答案>>(19分)A、B、C、D均为短周期元素,A和B是同周期相邻的两种元素,A和C是同主族相邻的两种元素;A,B、C三种元素的原子序数之和为31;D元素与A、B、C三种元素既不同周期,也不同主族。请回答:
(1)C元素的名称 。
(2)A、B、D可组成化学式为D4B2A3的离子化合物,其水溶液呈酸性,原因是(用离子方程式表示) 。
(3)B、D形成的化合物液态时可发生微弱电离(电离过程与D2A的电离相似),电离产生
的阴离子的电子式为 。
(4)在一定温度下1L的固定容器中,通入一定量的BA2后,存在2BA2![]() B2A4的平衡体系,当达到平衡时,测知其中含有2mol的BA2和1mol的B2A4,则此时该可逆反应的化学平衡常数为 ,BA2的转化率为 。
B2A4的平衡体系,当达到平衡时,测知其中含有2mol的BA2和1mol的B2A4,则此时该可逆反应的化学平衡常数为 ,BA2的转化率为 。
 |
(5)已知:
①若余下![]() mL气体为 ,原混合气体中BA2的体积为 mL,A2的体积为 mL。
mL气体为 ,原混合气体中BA2的体积为 mL,A2的体积为 mL。
②若余下![]() mL气体为 ,原混合气体中BA2的体积为 mL,A2的体积为 mL。
mL气体为 ,原混合气体中BA2的体积为 mL,A2的体积为 mL。
(6分)下列说法正确的是 (填序号)。
①由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
②水的沸点是100℃,酒精的沸点是78.5℃,用直接蒸馏法能使含水酒精变为无水酒精
③由于胶粒的直径比离子大,所以淀粉溶液中混有的碘化钾可用渗析法分离
④分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现
⑤由于高级脂肪酸钠盐在水中的分散质微粒直径在1nm~100 nm之间,所以可用食盐使高级脂肪酸纳从皂化反应后的混合物中析出
⑥不慎把苯酚溶液沾到皮肤上,应立即用酒精洗涤
⑦用稀溴水滴入苯酚溶液中制备2,4,6-三溴苯酚
⑧实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃
17..(18分)某化学小组采用类似制乙酸乙酯的装置(如右图),以环己醇制备环己烯:
 已知:
已知:
| 密度 | 熔点 | 沸点 | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是 ,
导管B除了导气外还具有的作用是 。
②试管C置于冰水浴中的目的是 。
 (2)制备精品
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和
食盐水,振荡、静置、分层,环己烯在 层(填
“上”或“下”),分液后用 (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从 口进入。
蒸馏时要加入生石灰,目的是: 。
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 ( )
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 ( )
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
18.(12分)有机
物A的结构简式为![]() ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。

请回答下列问题:
(1)指出反应的类型:A→C: 。
(2)在A~E五种物质中,互为同分异构体的是 (填代号)。
(3)写出由A生成B的化学方程式
。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(5)C能形成高聚物,该高聚物的结构简式为 。
(6)写出D与NaOH溶液共热反应的化学方程式
。
19.(16分)肉
桂酸甲酯( )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精
⑴肉桂酸甲酯的分子式是 ;
 ⑵下列有关肉桂酸甲酯的叙述中,正确的是 填字母);
⑵下列有关肉桂酸甲酯的叙述中,正确的是 填字母);
A.能与溴的四氯化碳溶液发生加成反应
B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应
D.不可能发生加聚反应
⑶G为肉桂酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。则G的结构简式为 ;
⑷用芳香烃A为原料合成G的路线如下:

①化合物E中的官能团有 (填名称)。
②F→G的反应类型是 ,该反应的化学方程式为 _ _ 。
③C→D的化学方程式为 _。
④写出符合下列条件的F的同分异构体的结构简式 。O%M
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。
20.(10分)有机物A的蒸汽对同温同压下氢气的相对密度为31,取3.1克A物质在足量氧气中充分燃烧,只生成2.7克水和标准状况下CO22.24L,求有机物的分子式;若该有机物0.2mol恰好与9.2克金属钠完全反应,请写出有机物的结构简式并命名。
查看习题详情和答案>>工业含铬(Cr)废水的处理原理是将Cr2O72-转化为Cr3+,再将Cr3+转化为沉淀.废水pH与Cr2O72-转化为Cr3+的关系如图1,实验室模拟工业电解法处理含铬废水的装置如图2:

请根据以上知识回答下列问题:
(1)含铬废水预处理的方法是______.
(2)在图2中连接铁棒的一极是电源的______极.
(3)实验中除能观察到废水颜色发生变化外,还能观察到的现象是______.
表一:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cr(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.5 | 4.3 | 3.4 |
| 完全沉淀 | 4.1 | 9.7 | 5.6 | 5.2 |
(5)含铬废水国家排放标准为
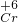 含量≤0.1000mg/L.取上述电解后的废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL.已知酸性条件下,I-被Cr2O72-氧化的产物为I2.用计算所得数据说明上述电解法处理后的废水是否符合国家排放标准______.
查看习题详情和答案>>
含量≤0.1000mg/L.取上述电解后的废水200.00mL,调节pH=1后置于锥形瓶中,用浓度为0.0001mol/L的KI溶液滴定,至滴定终点时,用去KI溶液9.00mL.已知酸性条件下,I-被Cr2O72-氧化的产物为I2.用计算所得数据说明上述电解法处理后的废水是否符合国家排放标准______.
查看习题详情和答案>>