摘要:已知高温下能发生如下反应SiO2+2C==Si+2CO↑.Si+C==SiC, 现有石英砂和碳粉的混合物 l mol,在高温电炉中隔绝空气充分反应完全后.冷却得到残留固体.若石英砂与混合物的物质的量之比为x, 试讨论x的取值范围.残留固体的成分和物质的量, 并将结果填入下表: 编号 ① ② ③ ④ ⑤ x值 x= 残留固体及 物质的量 Si mol
网址:http://m.1010jiajiao.com/timu3_id_350432[举报]
晶体硅是一种重要的非金属材料.制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅 ②粗硅与干燥HCl气体反应制SiHCl3:Si+3HCl
SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅.
已知SiHCl3能与H2O强烈反应,在空气中易自燃.请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:
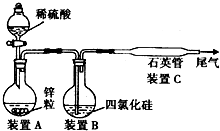
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
①装置B中的试剂是
②反应一段时间后,装置D中观察到的现象是
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水b.氯水c.NaOH溶液d.KSCN溶液e.Na2SO3溶液.
查看习题详情和答案>>
①高温下用碳还原二氧化硅制得粗硅 ②粗硅与干燥HCl气体反应制SiHCl3:Si+3HCl
| ||
③SiHCl3与过量H2在1000~1100℃反应制得纯硅.
已知SiHCl3能与H2O强烈反应,在空气中易自燃.请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
SiO2+2C
Si+2CO↑
| ||
SiO2+2C
Si+2CO↑
.
| ||
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为:
分馏
分馏
.(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
①装置B中的试剂是
浓硫酸
浓硫酸
,装置C中的烧瓶需要加热,其目的是:使滴入烧瓶中的SiHCl3气化
使滴入烧瓶中的SiHCl3气化
.②反应一段时间后,装置D中观察到的现象是
英管的内壁附有灰黑色晶体
英管的内壁附有灰黑色晶体
,装置D不能采用普通玻璃管的原因是高温下,普通玻璃会软化
高温下,普通玻璃会软化
,装置D中发生反应的化学方程式为SiHCl3+H2
Si+3HCl
| ||
SiHCl3+H2
Si+3HCl
.
| ||
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
先通一段时间H2,将装置中的空气排尽
先通一段时间H2,将装置中的空气排尽
.④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
bd
bd
a.碘水b.氯水c.NaOH溶液d.KSCN溶液e.Na2SO3溶液.

 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅:SiO2+2C
| ||
②粗硅与干燥的Cl2反应制得SiCl4:Si+2C12
| ||
③SiCl4被过量的H2在1 000~1 100℃时还原制得纯硅:SiCl4+2H2
| ||
某同学从资料中查知:SiCl4的熔点为-7O℃,沸点为57.6℃,且在潮湿的空气中能发生水解反应.该同学设计了如下制取纯硅的实验装置(热源及夹持装置已略去).请回答下列问题:
(1)使SiCl4从装置B中逸出与H2充分混合,应采取的措施是
对装置B水浴加热
对装置B水浴加热
.(2)装置C不能采用普通玻璃管的原因是
在1000-1100℃时普通玻璃管会软化
在1000-1100℃时普通玻璃管会软化
,石英的化学式是SiO2
SiO2
.(3)如果从装置A中快速向装置B中通入气体,可能观察到的现象是
B中液面上方产生少量白雾,液体中有少量白色胶状物生成
B中液面上方产生少量白雾,液体中有少量白色胶状物生成
.(4)为防止空气污染,含有SiCl4的尾气要通入盛有
NaOH
NaOH
溶液的烧杯中,反应的化学方程式为SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O
SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O
.(5)为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度,还应对该装置进行的改进是
在装置A与B之间连接一盛有浓硫酸的洗气瓶(或盛有碱石灰的干燥管).
在装置A与B之间连接一盛有浓硫酸的洗气瓶(或盛有碱石灰的干燥管).
.晶体硅是一种重要的非金属材料,制备高纯硅的主要流程如图所示:

已知SiHCl3能与H2O强烈反应,生成一种可燃烧的单质气体和两种酸.请回答下列问题:
(1)写出制备粗硅的化学方程式
(2)在生成SiHCl3的反应中,还原剂与还原产物的质量比为
(3)整个制备过程必须控制无水无氧,若有水可能发生的反应是
(4)下列关于硅及其化合物的叙述错误的是
A.二氧化硅晶体中硅氧原子间以共价键结合
B.用于现代通讯的光导纤维的主要成分是高纯度的硅
C.硅与碳位于同一主族,性质相似,在自然界中广泛存在着游离态的硅
D.SiO2和CO2都是酸性氧化物,均可与强碱(如NaOH)溶液反应,而不与任何酸反应.
查看习题详情和答案>>

已知SiHCl3能与H2O强烈反应,生成一种可燃烧的单质气体和两种酸.请回答下列问题:
(1)写出制备粗硅的化学方程式
SiO2+2C
Si+2CO
| ||
SiO2+2C
Si+2CO
.
| ||
(2)在生成SiHCl3的反应中,还原剂与还原产物的质量比为
14:1
14:1
.(3)整个制备过程必须控制无水无氧,若有水可能发生的反应是
3SiHCl3+3H2O=H2SiO3+H2↑+3HCl、C+H2O
CO+H2
| ||
3SiHCl3+3H2O=H2SiO3+H2↑+3HCl、C+H2O
CO+H2
.
| ||
(4)下列关于硅及其化合物的叙述错误的是
B C D
B C D
(填字母代号)A.二氧化硅晶体中硅氧原子间以共价键结合
B.用于现代通讯的光导纤维的主要成分是高纯度的硅
C.硅与碳位于同一主族,性质相似,在自然界中广泛存在着游离态的硅
D.SiO2和CO2都是酸性氧化物,均可与强碱(如NaOH)溶液反应,而不与任何酸反应.
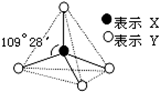 甲、乙、丙、丁均具有如图所示的结构或结构单元.实线表示共价键,X、Y可同可不同.
甲、乙、丙、丁均具有如图所示的结构或结构单元.实线表示共价键,X、Y可同可不同.已知:甲、乙晶体类型相同,单质甲能与乙发生置换反应,丙、丁、戊三种粒子均含有等量的总电子数,其中丙、戊是同一类晶体中的分子,戊在常温下呈液态,能产生两种10电子的离子,丁是阳离子且与丙符合“等电子原理”(具有相同电子数和原子数的分子或离子互称为等电子体).
(1)写出液态戊产生两种等电子粒子的电离方程式:
2H2O?H3O++OH-
2H2O?H3O++OH-
.(2)写出甲与乙发生置换反应的反应方程式:
SiO2+2C
Si+2CO↑
| ||
SiO2+2C
Si+2CO↑
.
| ||
(3)丙是目前重要的能源之一.
①丙和戊在催化、加热条件下得到可燃性的两种气体,其反应的化学方程式是:
CH4+H2O
CO+3H2
| 催化剂 |
| △ |
CH4+H2O
CO+3H2
.| 催化剂 |
| △ |
②现代高能电池中,常用丙作燃料电池的原料,在碱性介质(KOH溶液)的情况下,其负极反应的电极方程式为
CH4+10OH--8e-=CO32-+7H2O
CH4+10OH--8e-=CO32-+7H2O
.(4)含丁的硝酸盐溶液显酸性,原因是(用离子方程式表示):
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.晶体硅是一种重要的非金属材料.请写出晶体硅的二种用途:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3(常温下为液态,易挥发)
③SiHCl3与过量H2在1000~1100℃反应制得纯硅.
已知:
Ⅰ.SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:
Ⅱ.SiHCl3 在空气中自燃.请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)

①装置B中的试剂是
②反应一段时间后,装置D中观察到的现象是
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
④设计鉴定产品硅中是否含少量Fe单质的方法:
查看习题详情和答案>>
计算机芯片
计算机芯片
、太阳能电池
太阳能电池
.制备纯硅的主要步骤如下:①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3(常温下为液态,易挥发)
③SiHCl3与过量H2在1000~1100℃反应制得纯硅.
已知:
Ⅰ.SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式:
SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑
SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑
.Ⅱ.SiHCl3 在空气中自燃.请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为
SiO2+2C
Si+2CO↑
| ||
SiO2+2C
Si+2CO↑
.
| ||
(2)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)

①装置B中的试剂是
浓H2SO4
浓H2SO4
,装置C中的烧瓶需要加热,其目的是使SiHCl3气化
使SiHCl3气化
;②反应一段时间后,装置D中观察到的现象是
D石英管的内壁附有灰黑色晶体
D石英管的内壁附有灰黑色晶体
,装置D中发生反应的化学方程式为SiHCl3+H2
Si+3HCl
| ||
SiHCl3+H2
Si+3HCl
;
| ||
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
先通一段时间H2,将装置中的空气排尽
先通一段时间H2,将装置中的空气排尽
;④设计鉴定产品硅中是否含少量Fe单质的方法:
取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若出现红色说明含Fe,若不出现红色说明不含Fe.
取少量产品于试管中加盐酸溶解,再滴加氯水和KSCN(aq),若出现红色说明含Fe,若不出现红色说明不含Fe.
.