网址:http://m.1010jiajiao.com/timu3_id_350298[举报]
依照阿伏加德罗定律,下列叙述正确的是
( ) A.同温同压下两种气体的体积之比等于摩尔质量之比。
B.同温同压下两种气体的物质的量之比等于密度之比。 C.同温同压下两种气体的摩尔质量之比等于密度之比。D.同温同体积下两种气体的物质的量之比等于压强之比。
设NA表示阿伏加德罗常数,下列说法不正确的是 ( )
A. 醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等。
B.标准状况下,以任意比混和的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2 NA。
C.1L1mol/LCuCl2溶液中含有的Cu2+的个数为NA。
D.25℃,1.01×105Pa时,16g臭氧所含的原子数为NA。
设NA表示阿伏加德罗常数的数值,下列说法正确的是 ( )
A.用惰性电极电解500mL饱和食盐水时,若溶液的pH值变为14时,则电极上转移的电子数目为NA。
B.在标准状况下,各为1mol的二氧化硫、三氧化硫的体积均约为22.4L。
C. 在常温常压下,6g石英晶体中,含有0.4NA个硅氧共价键。
D.120g由NaHSO4和KHSO3组成的混合物中含有硫原子NA个。
标准状况下,下列混合气体的平均式量可能是50的是 ( )
A.硫化氢和二氧化硫 B.一氧化氮和氧气
C.二氧化硫和溴化氢 D.碘化氢和氯气
在一个恒容密闭容器中充入11gX气体(摩尔质量为 44g·mol-1),压强为1×105pa。如果保持温度不变,继续充入X气体,使容器内压强达到5×105pa。则此时容器内的气体X的分子数约为 ( )
A.3.3×1025 B.3.3×1024 C.7.5×1023 D.7.5×1022
由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同。则该混合气体中二氧化碳、氢气、一氧化碳的体积比为 ( )
A.29∶8∶13 B.22∶1∶14 C.13∶8∶29 D.26∶16∶57
同温、同压下,CO2 和NO的混合气体 20mL,通过足量过氧化钠后气体体积减少到10mL,则原混合气体的体积比可能是 ( )
A.1∶1 B.2∶3 C.3∶2 D.1∶4
乙炔和乙烯的混合气体完全燃烧时,所需氧气的体积是原混合气体的2.7倍,则该混合气体与足量的H2发生加成反应时,消耗H2的体积是原混合气体体积的 ( ) A.1.6倍 B.1.8倍 C.1.4倍 D.1.2倍
在一定条件下,将5体积NO、5体积NO2、6体积O2混合气体置于试管中,并将试管倒立于水槽中,充分反应后,剩余气体的体积是 ( )
A.1体积 B.2体积 C.3体积 4.4体积
19世纪,化学家对氧化锆的化学式有争议.经测定锆的相对原子质量为91,其氯化物蒸气的密度是同溶、同压下H2密度的116-117倍,试判断与氯化物价态相同的氧化锆的化学式 ( )
A.ZrO B.Zr2O C.Zr2O3 D.ZrO2
常温下,向20L真空容器中通入A mol硫化氢和 Bmol氯气(A,B均为不超过5的正整数),反应完全后,容器内气体可能达到的最大密度是 ( )
A.8.5 g·L-1 B.18.25g·L-1 C.18.5 g·L-1 D.35.5 g· L-1
查看习题详情和答案>>恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示.
(已知:2SO2 (g)+O2(g) 2SO3(g)
△H=-196.6 KJ·mol- 1)
2SO3(g)
△H=-196.6 KJ·mol- 1)
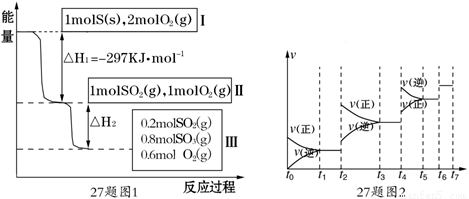
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: .
(2)ΔH2 =
(3)恒温恒容时,1molSO2和2molO 2 充分反应,放出热量的数值比∣ΔH2 ∣ (填“大”、“小”或 “相等”)
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为 .
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2 )增大的有 .
a.升高温度;
b.充入He气
c.再充入1molSO2 (g)和1molO 2 (g)
d.使用催化剂
(6)某SO2 (g)和O2
(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率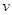 与时间t的关系如图2所示,若不改变SO2 (g)和O2
(g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是
.
与时间t的关系如图2所示,若不改变SO2 (g)和O2
(g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是
.
查看习题详情和答案>>
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源。
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+ I2=H2SO4+2HI
Ⅱ.2HI
 H2+I2
H2+I2 Ⅲ.2H2SO4=2SO2+O2+2H2O
分析上述反应,下列判断正确的是_________(填序号,下同)。
a.反应Ⅲ易在常温下进行
b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH =+206.1 kJ·mol-1
若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0 mol·L-1;c(H2O)=8.5 mol·L-1;c(CO)=2.0 mol·L-1;c(H2)=2.0 mol·L-1,则此时正逆反应速率的关系是v正___________(填“>”、“<”或“=”) v逆。
③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡____________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的_____________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g)
 CH3OH(g) 分析该反应并回答下列问题:
CH3OH(g) 分析该反应并回答下列问题: ①下列各项中,不能说明该反应已达到平衡的是______________。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
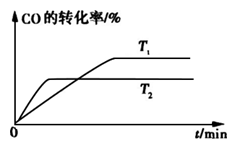
②如图是该反应在不同温度下CO的转化率随时间变化的曲线。
③已知甲醇燃料电池的工作原理如图所示。

Fe和AL是两种常用的金属,将它们按一定的质量比组成混合物。
⑴称取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为nL,反应的离子方程式为 ,混合物中Al的物质的量为 (用含字母的数学式表示);
⑵另取相同质量的该混合物,向其中加入足量的稀硫,固体全部溶解,生成气体的体积在标准状况下为m L,则反应中转移电子的物质的量为 ,混合物中Fe的质量为 (用含字母的数学式表示);
⑶向⑵所得的溶液中加入过量的氢氧化钠溶液,将产生的沉淀过滤,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为 。
查看习题详情和答案>>Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得.则该反应的氧化产物与还原产物的物质的量之比是
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如图1:

(2)写出电解时发生反应的化学方程式:
| ||
| ||
(3)除去ClO2中的NH3可选用的试剂是
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.水
(4)测定ClO2(如图2)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去V mL硫代硫酸钠溶液.
①装置中玻璃液封管的作用是
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式
③滴定终点的现象是:
④测得通入ClO2的质量m(ClO2)=
(5)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2-.2001年我国卫生部规定,饮用水的ClO2-含量应不超过0.2mg/L.若饮用水中ClO2-的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是