摘要:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,
网址:http://m.1010jiajiao.com/timu3_id_350281[举报]
A、B、C、D是同一周期的4种元素,A、B、C的原子序数依次相差为1,A元素的单质化学性质活泼.A元素原子半径在本周期中最大.2.00g B元素的氧化物恰好和100mL 0.50mol?L-1稀硫酸完全反应.B元素的单质跟D元素单质反应生成化合物BD2.试回答:
(1)写出A、B、C、D 4种元素最高价氧化物对应水化物的化学式,并按碱性逐渐减弱,酸性逐渐增强的顺序加以排列:
(2)写出下列反应的离子方程式:
①将C的氧化物投入到A的氧化物的水化物中:
②将C的氧化物投入到D的氢化物的水溶液中:
(3)B的单质投入沸水中反应的化学方程式:
查看习题详情和答案>>
(1)写出A、B、C、D 4种元素最高价氧化物对应水化物的化学式,并按碱性逐渐减弱,酸性逐渐增强的顺序加以排列:
NaOH、Mg(OH)2、Al(OH)3、HClO4
NaOH、Mg(OH)2、Al(OH)3、HClO4
.(2)写出下列反应的离子方程式:
①将C的氧化物投入到A的氧化物的水化物中:
Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
.②将C的氧化物投入到D的氢化物的水溶液中:
Al2O3+6H+═2Al3++3H2O
Al2O3+6H+═2Al3++3H2O
.(3)B的单质投入沸水中反应的化学方程式:
Mg+H2O(沸水)═Mg(OH)2+H2↑
Mg+H2O(沸水)═Mg(OH)2+H2↑
.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同?
(2)写出实验3中的电极反应式.
铝为
石墨为
(3)实验4中的铝作正极还是负极?写出电池总反应方程式
(4)解释实验5中电流指针偏向铝的原因
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极受哪些因素的影响?
查看习题详情和答案>>
| 编号 | 电极材料 | 电解质溶液 | 电流指针偏转方向 |
| 1 | Mg Al | 稀盐酸 | 偏向Al |
| 2 | Al Cu | 稀盐酸 | 偏向Cu |
| 3 | Al 石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg Al | NaOH溶液 | 偏向Mg |
| 5 | Al Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极是否相同?
不同
不同
.(2)写出实验3中的电极反应式.
铝为
负极
负极
,2Al-6e-→2Al3+
2Al-6e-→2Al3+
;石墨为
正极
正极
,6H++6e-→3H2↑
6H++6e-→3H2↑
;(3)实验4中的铝作正极还是负极?写出电池总反应方程式
负极;2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
负极;2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
.(4)解释实验5中电流指针偏向铝的原因
Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电子由正极流向负极,所以电流计指针偏向铝.
Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电子由正极流向负极,所以电流计指针偏向铝.
.(5)根据实验结果总结:在原电池中金属铝作正极还是作负极受哪些因素的影响?
(2012?凯里市模拟)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
请根据以下实验事实逐步推出它们的名称并回答问题:
(1)
(2)写出E溶液与过量的B溶液反应的离子方程式:
(3)在100mL 0.1mol/L的E溶液中,逐滴加入35mL 2mol/L NaOH溶液,最终得到沉淀的物质的量为
查看习题详情和答案>>
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
(1)
| 物质鉴定实验 | 推导结论 |
| ①用pH试纸测出A、B溶液呈碱性,C、D、E溶液呈酸性 | A、B中含有的阴离子为 CO32-、OH- CO32-、OH- ,C、D、E中含有的阳离子为H+、Al3+、Ag+ H+、Al3+、Ag+ |
| ②A溶液与E溶液反应既有气体又有沉淀产生;A与C反应只有气体产生 | A为 Na2CO3 Na2CO3 ,C含有的阳离子为H+ H+ |
| ③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀 | D为 AgNO3 AgNO3 |
2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓
2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓
.(3)在100mL 0.1mol/L的E溶液中,逐滴加入35mL 2mol/L NaOH溶液,最终得到沉淀的物质的量为
0.01mol
0.01mol
.A、B、C是中学化学常见物质,含有同一种元素.其转化关系如下: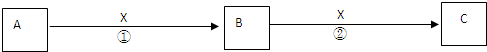
(1)若X为无色无味的气体,是一种常用氧化剂.A为气体化合物,溶于水后所得溶液使红色石蕊试纸呈蓝色.该转化关系是工业制硝酸的反应原理.则A的电子式是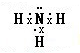
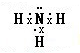 .
.
(2)若X为还原剂.将5~6滴A的饱和溶液滴入沸水中,可得到红褐色液体,该液体能产生丁达尔效应.反应②的离子方程式为
(3)若X为一种常见的碱,A、C均为盐,B为白色胶状沉淀,几乎不溶于水,但能凝聚水中的悬浮物.已知Na2S溶液显碱性,向A的溶液中加入Na2S溶液,生成具有臭鸡蛋气味的气体H2S,反应的离子方程式为
查看习题详情和答案>>

(1)若X为无色无味的气体,是一种常用氧化剂.A为气体化合物,溶于水后所得溶液使红色石蕊试纸呈蓝色.该转化关系是工业制硝酸的反应原理.则A的电子式是
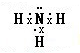
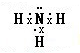
(2)若X为还原剂.将5~6滴A的饱和溶液滴入沸水中,可得到红褐色液体,该液体能产生丁达尔效应.反应②的离子方程式为
Zn+Fe2+=Zn2++Fe
Zn+Fe2+=Zn2++Fe
.(3)若X为一种常见的碱,A、C均为盐,B为白色胶状沉淀,几乎不溶于水,但能凝聚水中的悬浮物.已知Na2S溶液显碱性,向A的溶液中加入Na2S溶液,生成具有臭鸡蛋气味的气体H2S,反应的离子方程式为
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑
.