网址:http://m.1010jiajiao.com/timu3_id_349913[举报]
①试样中含有加热不挥发的杂质 ②试样中含有加热易挥发的杂质 ③测试前试样已有部分脱水
④实验前坩埚未完全干燥 ⑤晶体加热脱水不完全 ⑥加热时晶体溅出
B.②④⑤
C.②④⑥
D.①②③
硫酸铜晶体中结晶水含量的测定实验方案中,下列情况可能造成测试结果偏高的是
①试样中含有加热不挥发的杂质 ②试样中含有加热易挥发的杂质 ③测试前试样已有部分脱水 ④实验前坩埚未完全干燥 ⑤晶体加热脱水不完全 ⑥加热时晶体溅出
A.①③④ B.②④⑤ C.②④⑥ D.①②③
![]()
下列实验操作,将会使测得的w(结晶水)与晶体所带结晶水实际含量相比是偏高、偏低、还是没有影响?
(1)晶体加热过程中,有少量晶体颗粒溅出,将使测定结果偏______;(2)晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上冷却,将使测定结果偏______;(3)加热后,晶体变为灰色,将使测定结果偏______。
查看习题详情和答案>>(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、_______、_______。
(3)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。

请回答下列问题:
①能用作干燥氨气的装置有_____________(填字母);
②既能用于收集氯气又能用于收集一氧化氮气体的装置有____________ (填字母);
③在实验室制备氯气的实验中,用以除去氯气中氯化氢等杂质气体的装置有___________(填字母);
④能用于乙烯与溴水反应制二溴乙烷的实验装置有____________(填字母);
⑤在C装置中,若用烧杯内的氢氧化钠溶液吸收尾气二氧化硫,则广口瓶的作用是____________。
(4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了下图所示的实验。
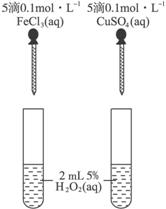
①可通过观察__________________________________________来定性的得出结论;
②有A同学提出将CuSO4改为CuCl2更为合理,其理由是_____________________________
_____________________________________________________________________;
若不采用A同学的改进方案,你认为还可以如何改进?
____________________________________________________________________
___________________________________________________________________
____________________________________________________________________。
查看习题详情和答案>>