网址:http://m.1010jiajiao.com/timu3_id_349894[举报]
某化学小组用下列如下图所示装置制取氢气,再用制得的氢气还原氧化铜,最后根据氧化铜质量的减少和无水氯化钙质量的增加来测定水的质量组成.

(1)如果制得的![]() 从左向右流,上述必要仪器的连接顺序是________接________,________接________,________接________,________接________,________接________(碱石灰).
从左向右流,上述必要仪器的连接顺序是________接________,________接________,________接________,________接________,________接________(碱石灰).
(2)简要说明实验装置最后连接碱石灰干燥管的目的是___________.
(3)装入药品后,进行实验时有如下操作步骤:①打开活塞,产生氢气;②点燃d处酒精灯;③检查装置的气密性;④关闭活塞,停止产生氢气;⑤待氧化铜变红后撤去酒精灯;⑥通入氢气,使d中的物质冷却;⑦称量c管和d管的质量.
正确的操作顺序是________→________→________→________→________→________→________→⑦
(4)若原质量为![]() g的硬质玻管d反应后质量变为
g的硬质玻管d反应后质量变为![]() g;U形管在实验后质量增加m,则水中氢、氧两元素的质量比可表示为________.
g;U形管在实验后质量增加m,则水中氢、氧两元素的质量比可表示为________.
(5)若实验中有部分氧化铜还原不彻底,未生成铜而是被还原为红色的氧化亚铜(![]() )对实验结果有何影响________(填“偏大”、“偏小”或“无影响”).
)对实验结果有何影响________(填“偏大”、“偏小”或“无影响”).
查看习题详情和答案>>

(1)如果制得的![]() 从左向右流,上述必要仪器的连接顺序是________接________,________接________,________接________,________接________,________接________(碱石灰).
从左向右流,上述必要仪器的连接顺序是________接________,________接________,________接________,________接________,________接________(碱石灰).
(2)简要说明实验装置最后连接碱石灰干燥管的目的是___________.
(3)装入药品后,进行实验时有如下操作步骤:①打开活塞,产生氢气;②点燃d处酒精灯;③检查装置的气密性;④关闭活塞,停止产生氢气;⑤待氧化铜变红后撤去酒精灯;⑥通入氢气,使d中的物质冷却;⑦称量c管和d管的质量.
正确的操作顺序是________→________→________→________→________→________→________→⑦
(4)若原质量为![]() g的硬质玻管d反应后质量变为
g的硬质玻管d反应后质量变为![]() g;U形管在实验后质量增加m,则水中氢、氧两元素的质量比可表示为________.
g;U形管在实验后质量增加m,则水中氢、氧两元素的质量比可表示为________.
(5)若实验中有部分氧化铜还原不彻底,未生成铜而是被还原为红色的氧化亚铜(![]() )对实验结果有何影响________(填“偏大”、“偏小”或“无影响”).
)对实验结果有何影响________(填“偏大”、“偏小”或“无影响”).
查看习题详情和答案>>
某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。
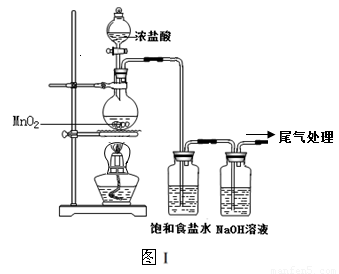
实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是 。
(2)饱和食盐水的作用是 。
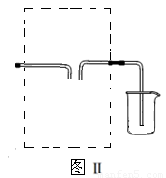
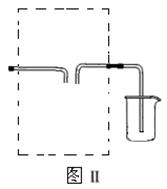
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═ NaCl(aq)+NaClO(aq)+H2O(l)H1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)H2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议: 。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是 。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是 。
查看习题详情和答案>>
(16分)某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。
实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是 。
(2)饱和食盐水的作用是 。
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:
ⅰ.NaClO把Na2SO3氧化了 ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是 (填序号)。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是 。
某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。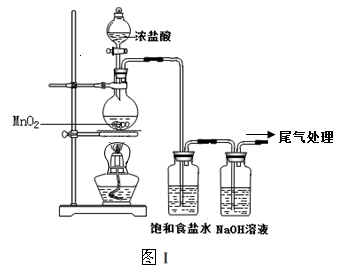

实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是 。
(2)饱和食盐水的作用是 。
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═ NaCl(aq)+NaClO(aq)+H2O(l)??H1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)??H2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议: 。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是 。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是 。