网址:http://m.1010jiajiao.com/timu3_id_349870[举报]
(9分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL
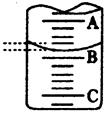
(3)滴定操作时,眼睛应注视
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均 为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液时,为充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简,需带单位)c(醋酸)= 查看习题详情和答案>>
(9分)某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
(1)该实验应选用 作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器名称是
(2)下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL

(3)滴定操作时,眼睛应注视
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均 为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
消耗NaOH溶液体积/mL |
26.02 |
25.35 |
25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水洗过,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
E.滴加NaOH溶液时,为充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简,需带单位)c(醋酸)=
查看习题详情和答案>>
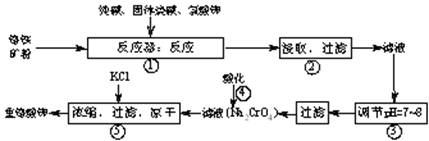
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO?Cr2O3)为原料生产.实验室模拟工业生产如下图:
涉及的主要反应为:6FeO?Cr2O3+24NaOH+7KClO3 12Na2CrO4+3Fe2O3+7KCl+12H2O
12Na2CrO4+3Fe2O3+7KCl+12H2O
在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐.氧化铝与碳酸钠发生的反应为Al2O3+Na2CO3 2NaAlO2+CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O?NaAl(OH)4?Al(OH)3+NaOH.
2NaAlO2+CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O?NaAl(OH)4?Al(OH)3+NaOH.
(1)写出二氧化硅与碳酸钠反应的化学方程式______.
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,试写出该反应的化学方程式:______.
(3)操作③调节后溶液的pH比原来降低,调节的目的是(用简要的文字和必要的离子方程式说明)______.
(4)称取重铬酸钾(K2Cr2O7式量为294)试样m g配成VmL溶液,取出V1 mL于锥形瓶中,加入适量的稀H2SO4和足量碘化钾,放于暗处5min,然后加入100mL水,同时加入3mL淀粉溶液作指示剂,用c mol?L-1Na2S2O3标准溶液滴定(相关反应为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- ).则:
①取V1 mL待测液应选用的仪器为______(写仪器名称).
②判断达到滴定终点的依据是______.
③设整个过程中其它杂质不参与反应.若实验中共用去Na2S2O3标准溶液V2mL,则计算所得产品中重铬酸钾纯度的代数式为______(不必化简).
查看习题详情和答案>>
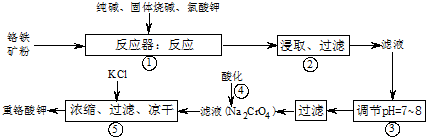
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产。实验室模拟工业生产如下图:
|
 涉及的主要反应为:
涉及的主要反应为:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4 +3Fe2O3+7KCl+12H2O

 在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3 2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O NaAl(OH)4
在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3 2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O NaAl(OH)4
 Al(OH)3+NaOH。
Al(OH)3+NaOH。
(1)写出二氧化硅与碳酸钠反应的化学方程式 。
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,试写出该反应的化学方程式:
。
(3)操作③调节后溶液的pH比原来降低,调节的目的是(用简要的文字和必要的离子方程式说明)
。
(4)称取重铬酸钾(K2Cr2O7式量为294)试样m g配成VmL溶液,取出V1 mL于锥形瓶中,加入适量的稀H2SO4和足量碘化钾,放于暗处5min,然后加入100mL水,同时加入3mL淀粉溶液作指示剂,用c mol•L-1Na2S2O3标准溶液滴定(相关反应为: Cr2O72-+6I-+14H+= 2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- )。则:
①取V1mL待测液应选用的仪器为 (写仪器名称)。
②判断达到滴定终点的依据是 。
③设整个过程中其它杂质不参与反应。若实验中共用去Na2S2O3标准溶液V2mL,则计算所得产品中重铬酸钾纯度的代数式为
(不必化简)。
查看习题详情和答案>>
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO·Cr2O3)为原料生产。实验室模拟工业生产如下图:
|
 涉及的主要反应为:
涉及的主要反应为:
6FeO·Cr2O3+24NaOH+7KClO3 12Na2CrO4 +3Fe2O3+7KCl+12H2O

 在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3
2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O
NaAl(OH)4
在反应器中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐。氧化铝与碳酸钠发生的反应为Al2O3 + Na2CO3
2NaAlO2 +CO2↑,生成的偏铝酸钠(NaAlO2)可与水反应NaAlO2+2H2O
NaAl(OH)4
 Al(OH)3+NaOH。
Al(OH)3+NaOH。
(1)写出二氧化硅与碳酸钠反应的化学方程式 。
(2)NaFeO2能强烈水解,在操作②中生成沉淀而除去,试写出该反应的化学方程式:
。
(3)操作③调节后溶液的pH比原来降低,调节的目的是(用简要的文字和必要的离子方程式说明)
。
(4)称取重铬酸钾(K2Cr2O7式量为294)试样m g配成VmL溶液,取出V1 mL于锥形瓶中,加入适量的稀H2SO4和足量碘化钾,放于暗处5min,然后加入100mL水,同时加入3mL淀粉溶液作指示剂,用c mol•L-1Na2S2O3标准溶液滴定(相关反应为: Cr2O72-+6I-+14H+= 2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62- )。则:
①取V1 mL待测液应选用的仪器为 (写仪器名称)。
②判断达到滴定终点的依据是 。
③设整个过程中其它杂质不参与反应。若实验中共用去Na2S2O3标准溶液V2mL,则计算所得产品中重铬酸钾纯度的代数式为
(不必化简)。
查看习题详情和答案>>