网址:http://m.1010jiajiao.com/timu3_id_349841[举报]
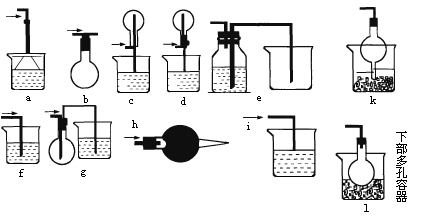
下图所示是课外活动小组同学设计的几种尾气吸收装置(装置中的液体为水,固体为碱石灰).从实验安全和保护环境的角度考虑,当用于吸收HCl气体时,应选用的装置是(选填装置序号)________.若用于吸收NH3,在上述已选用的装置中不宜采用的是________,原因是________.
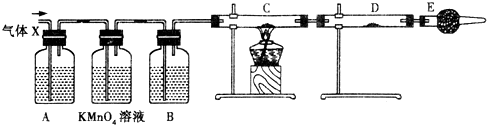
注:C中为氧化铜粉末,试回答下列问题:
(1)上述反应中生成二氧化硫的化学方程式为:
| ||
| ||
(2)乙同学认为还可能产生氢气的理由是:
(3)丙同学在安装好装置后,必不可少的一步操作是:
(4)A中加入的试剂可能是
(5)可以证明气体X中含有氢气的实验现象是:

(1)在实验时打开A中分液漏斗的活塞后,漏斗中的液体没有顺利流下,其可能原因是
(2)上述装置中明显存在不足之处,为保证装置B中实验成功,应在装置A、B之间添加一个装置,该装置是图2中的
(3)装置C中溶液发生的颜色变化为
 ,请在方框内写出导致该阶段颜色变化的粒子符号.
,请在方框内写出导致该阶段颜色变化的粒子符号.(4)装置D中起始的实验现象是
(5)某同学认为SO2和Cl2都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果没有预期那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如图3所示实验装置.
①实验开始后,乙装置中出现的现象是
②用离子方程式表示乙中产生该现象的原因:

(1)A中浓硫酸的作用是___________________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:______________________。
(2)球形管C的作用是__________________________,若反应前向B中溶液滴加几滴酚酞,呈红色,产生此现象的原因是(用离子方程式表示)___________________________;反应结束后B中的现象是___________________________________。
(3)从B中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出___________________________;再加入无水硫酸钠,然后进行蒸馏,收集温度为__________________馏分,以得到较纯净的乙酸乙酯。
(4)试分析用氢氧化钠溶液来代替饱和碳酸钠溶液而导致的不利后果。__________________。
查看习题详情和答案>>某课外活动小组利用如下左图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白:
(1)检验乙醛的试剂是 ;
A.银氨溶液 B.碳酸氢钠溶液 C.新制氢氧化铜悬浊液 D.氧化铜
(2)乙醇发生催化氧化的化学反应方程式为 ;
(3)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是 ___ ,由于装置设计上的缺陷,实验进行时可能会 _____ 。
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如上右图所示。
试解释鼓气速度过快,反应体系温度反而下降的原因: ,该实验中“鼓气速度”这一变量你认为可用 来估量;
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
查看习题详情和答案>>