网址:http://m.1010jiajiao.com/timu3_id_349766[举报]
实验室中通常加热无水乙醇与浓硫酸的混合物的方法制取乙烯,浓硫酸的作用是乙醇反应的催化剂和吸水剂.在具体的化学实验中常因加热的温度过高导致副反应发生而使乙烯气体中混有二氧化硫气体.如图所表示的装置可以用于确认乙烯气体中混有二氧化硫气体.可选择的化学试剂有:

A.品红溶液 B.烧碱溶液 C.浓硫酸 D.酸性高锰酸钾溶液
回答下列问题:
(1)由乙醇生成乙烯的化学反应方程式是________,该化学反应所属的类型可以是________或________.
A.取代反应 B.加成反应 C.脱水反应 D.分解反应
(2)图中①、②、③、④的容器内盛放的化学试剂分别是(填写代号)
①________、②________、③________、④________.
(3)能说明二氧化硫气体存在的现象是________.
(4)使用装置②的目的是________;使用装置③的目的是________.
(5)确认乙烯气体存在的现象是________.
(6)实验室中可以采用将乙烯气体通入酸性高锰酸钾溶液的实验方法证明乙烯具有容易被氧化的化学性质.在将乙烯气体通入酸性高锰酸钾溶液之前要进行的一项实验是________.
铝是银白色的金属,铝粉也具有银白色的光泽,常用做涂料(俗称银粉、银漆),保护铁制品不被腐蚀,而且美观。铝板对光的反射性能也很好,反射紫外线的能力比银还强,常用来制造高质量的反射镜。铝的密度小,仅为2.7g?cm-3,属于轻金属,可以制成多种合金。铝合金主要用于建筑业、包装业、交通运输业以及电子行业等。
铝的导电性好,仅次于银、铜,导电率只有铜的2/3,但是密度只有铜的1/3,输送同样的电量用铝线的质量只有铜线的一半。铝的表面有一层致密的氧化膜,这层氧化膜不仅有耐腐蚀的能力,而且有一定的绝缘性,所以铝在电器制造工业、电线电缆工业和无线电工业中有广泛的用途。铝是热的良导体,比铁的导热能力大三倍,工业上可以用铝制造各种热交换器、散热材料和炊具等。铝还有良好的延展性,仅次于金和银,在100℃~150℃时可以制成薄于0.01mm的铝箔,广泛用于包装香烟和糖果等,还可以制成铝丝、铝条,并能轧制成各种铝制品。
铝的化学性质比较活泼,在氧气中容易燃烧放出大量的热和耀眼的光,常用于制造爆炸混合物、燃烧混合物和照明混合物。铝可以和其他的金属氧化物构成铝热剂,用来冶炼难熔金属和野外焊接钢轨等。铝还可以用做炼钢过程中的脱氧剂,它和石墨、二氧化钛或其他高熔点金属的混合物按一定比例均匀混合后,涂在金属表面,经高温煅烧而制成耐高温的金属陶瓷,在火箭及导弹技术上有重要应用。
由于铝的活泼性比较强,因此它主要以化合态的形式存在于自然界中。铝的氧化物Al2O3和氢氧化物Al(OH)3都是典型的两性物质,既能和酸发生反应,也能和碱发生反应。
生命起源于原始海洋,科学家认为由于海洋中Al3+浓度极低,所以铝元素不属于人体必需的微量元素,摄入过量的铝元素对人体有害。人体中铝元素的含量太多时,能影响人体对磷的吸收,导致骨质疏松,容易发生骨折。近年来又发现老年痴呆症与过多摄入铝元素有关。1989年世界卫生组织把铝列为食品污染物之一,铝每日的摄入量应控制在4mg以下。
材料问题:
1.请列举日常生活中铝元素进入人体的其他来源(至少两种):______
______________________________。
2.日常生活中有人用金属丝制成的清洁球擦洗铝锅,你认为这种方法恰当么?
3.炸油条时,1kg面粉加0.5kg水、4g明矾、小苏打及其他辅料共10g,若烹炸过程中质量减少30%,试通过计算说明100g油条中的含Al量是否超过安全摄入量。 查看习题详情和答案>>
A.不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛
B.酒精灯洒漏少量酒精着火,用湿布盖灭
C.实验剩余的NaOH放回原试剂瓶
D.在容量瓶中加入一定体积的水再加入浓硫酸,配置准确浓度的稀硫酸
E.知趣乙酸乙酯时,加热前应先向试管中加入碎瓷片
II、无水氯化铝为白色粉末,极易吸水,常压下182.7℃升华.学生甲拟选用如图所示仪器、装置(部分仪器连接的橡胶管或橡胶塞省略)和试剂制备无水氯化铝.
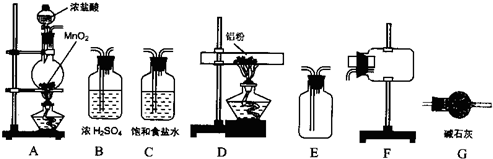
回答下列问题
(2)实验前,如何检查装置A的气密性
(3)装置A中反应的化学方程式为
| ||
| ||
(4)从上列仪器中选取制备无水氯化铝的装置,各装置的连接顺序为:
A→
(5)装置G的作用是
(6)学生乙提出另一种制备无水氯化铝的方案:将金属铝与足量盐酸反应后,将溶液加热蒸干、灼烧的到无水氯化铝.请你评价该方案是否可行,并说明理由
重庆开县的天然气矿“井喷”事故对人畜造成了极大的危害。主要原因是喷发出的天然气中含有浓度较大的硫化氢气体,这种无色气体具有臭鸡蛋气味,有剧毒,其毒性原理为阻断机体细胞的内呼吸导致全身性缺氧。由于中枢神经对缺氧最敏感,因而首先受到损害。其相对密度1.19,熔点
针对这次“井喷”事故,有专家提出如下现场处理措施:
(一)在井架入口、井架上、钻台边上、循环系统等处设置风向标,一旦发生紧急情况,作业人员可向(2)方向疏散。
(二)在钻台上下、振动筛、循环罐等气体易于积聚的场所,安装防暴排风扇以驱散工作场所弥漫的有害、可燃气体。含硫地区钻井队应配备便携式硫化氢检测仪(3)。
(三)在含硫地区钻井的生产班当班人员每人配一套空气呼吸器(4),另配一定数量的公用空气呼吸器,并做到人人会使用、会维护、会检查。钻井队钻井技术人员负责防硫化氢安全教育,队长负责监督检验。
(四)含硫地区钻井液的pH要求控制在(5)9.5。加强对钻井液中硫化氢浓度的测量,充分发挥除硫剂(6)和除气器的功能,保持钻井液中硫化氢浓度含量在15 mg·m-3以下(7)。
当硫化氢含量超过20 mg·m-3的安全临界浓度时,工作人员应佩戴空气呼吸器,不允许单独行动,派专人监护现场。
(五)钻井队在现场条件不能实施井控作业而决定放喷时,放出天然气烧掉(8)。放喷点火应派专人进行……
(1)硫化氢的水溶液叫氢硫酸,它具有( )
A.弱酸性、氧化性、还原性、易挥发性 B.强酸性、无氧化性、还原性、易挥发性
C.弱酸性、氧化性、无还原性、易挥发性 D.强酸性、氧化性、还原性、无挥发性
(2)如果你负责疏散受灾群众,那么,受灾人员的疏散方向是( )
A.顺风向 B.逆风向 C.地势高的方向 D .地势低的方向
(3)下列能用于检测硫化氢存在的是( )
A.品红试纸 B.石蕊试纸 C.pH试纸 D.醋酸铅试纸
(4)空气呼吸器中可盛放的物质是( )
A.氢氧化钠 B.过氧化钠 C.氯化钠 D.高锰酸钾
(5)文中(5)处应填( )
A.大于 B.小于 C.等于 D.不一定
(6)下列物质不可作为除硫化氢气体的是( )
A.NaOH溶液 B.CuSO4溶液 C.酸性KMnO4溶液 D.NaHS溶液
(7)检测人员从现场取出500 mL井液,经测量井液密度为
A.可安全生产 B.必须佩戴空气呼吸器
C.迅速离开现场 D.无法确定
(8)放喷的天然气为什么要烧掉?放喷点火人点火时应注意什么问题?
查看习题详情和答案>>清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH、Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。回答下列问题
Ⅰ.(1)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(2)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
|
|
实验事实 |
|
事实一 |
水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
|
事实二 |
盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
|
事实三 |
普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
|
事实四 |
在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
|
事实五 |
1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
结论:从实验上说明碱性水溶液条件下,H2O可作 剂;NaOH作_____ 剂,降低反应 。高温无水环境下,NaOH作 剂。
Ⅱ.在工业中利用镁制取硅:2Mg+SiO2 2MgO+Si,同时有副反应发生:2Mg+Si
2MgO+Si,同时有副反应发生:2Mg+Si Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:
Mg2Si,Mg2Si遇盐酸迅速反应生成SiH4(硅烷),SiH4在常温下是一种不稳定、易分解的气体。如图是进行Mg与SiO2反应的实验装置:

由于氧气的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。 a.石灰石 b.锌粒 c.纯碱
(4)实验开始时,必须先通入X气体,再加热反应物,其理由是______________________________,当反应开始后,移走酒精灯反应能继续进行,其原因是___________________________。
(5)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸。可观察到闪亮的火星,产生此现象的原因用化学方程式表示为_______________________________________。
查看习题详情和答案>>