网址:http://m.1010jiajiao.com/timu3_id_349724[举报]
(10分)某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
⑴氯气可以用于漂白、消毒的原因是氯气能与水作用形成具有 性的次氯酸。
 相关反应的离子方程式为 。
相关反应的离子方程式为 。
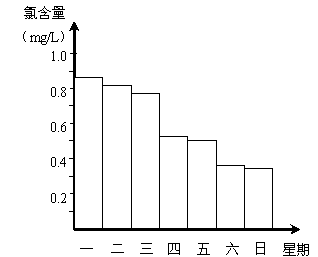
⑵在调查某室外游泳池夏季池水消毒情况时,小组成员了解到,该游泳池每周一上午8∶00换水,然后通入氯气消毒,检测到氯含量为0.9mg/L。(氯含量指每升水中含Cl2的质量,通常游泳池水的氯含量控制在0.5 mg/L至1.0mg/L之间时,效果最好)右图是该小组测定的某一周每天19∶00时游泳池中水的氯含量。有哪几天使用游泳池不卫生 。
⑶根据上图,你认为这一周中哪几天的天气炎热、阳光强烈 ,
说出一种理由是 。
⑷在对游泳池水中通入氯气消毒时,当发生氯气泄漏,应立即关闭氯气罐,还应采取下列自救方法 。(选填序号)
A.用湿润的毛巾捂住口鼻跑向低处
B.用浸湿小苏打或肥皂水的毛巾捂住口鼻跑向高处
C.用浸湿浓氨水的毛巾捂住口鼻匍匐前进至安全处
D.用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处
⑸小型游泳池通常使用漂白液(NaClO溶液)而非氯气来消毒池水,试举出使用漂白液而非氯气的一种理由 。
⑹请写出你知道的能用于自来水消毒的消毒剂的名称(至少写两种) 、 。
查看习题详情和答案>>(10分)某校高一化学研究性学习小组对日常生活中的氯气用途进行了调查,了解到氯
气可广泛地应用于衣物的漂白、水体的杀菌和消毒等。
⑴氯气可以用于漂白、消毒的原因是氯气能与水作用形成具有 性的次氯酸。
相关反应的离子方程式为 。
 ⑵在调查某室外游泳池夏季池水消毒情况时,
⑵在调查某室外游泳池夏季池水消毒情况时,
小组成员了解到,该游泳池每周一上午8∶00
换水,然后通入氯气消毒,检测到氯含量为0.9mg/L。
(氯含量指每升水中含Cl2的质量,通常游泳池水的氯
含量控制在0.5 mg/L至1.0mg/L之间时,效果最好)
右图是该小组测定的某一周每天19∶00时游泳池
中水的氯含量。有哪几天使用游泳池不卫生 。
⑶根据上图,你认为这一周中哪几天的天气炎热、阳光强烈 ,
说出一种理由是 。
⑷在对游泳池水中通入氯气消毒时,当发生氯气泄漏,应立即关闭氯气罐,还应采取下列
自救方法 。(选填序号)
A.用湿润的毛巾捂住口鼻跑向低处
B.用浸湿小苏打或肥皂水的毛巾捂住口鼻跑向高处
C.用浸湿浓氨水的毛巾捂住口鼻匍匐前进至安全处
D.用浸湿食盐水的毛巾捂住口鼻顺风跑至安全处
⑸小型游泳池通常使用漂白液(NaClO溶液)而非氯气来消毒池水,试举出使用漂白液而
非氯气的一种理由 。
⑹请写出你知道的能用于自来水消毒的消毒剂的名称(至少写两种) 、 。
查看习题详情和答案>>| A、实验室制取蒸馏水的实验,将温度计水银球插入自来水中 | B、分液时,分液漏斗下层液体先从下口放出,上层液体再从下口放出 | C、浓NaOH溶液溅到皮肤上,立即用大量水冲洗,然后涂上稀硼酸溶液 | D、配制硫酸溶液时,可先在量筒中加入一定体积的水,边搅拌边慢慢注入浓硫酸 |
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度 (g/100gH2O) |
9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.1×10-1 | 26.7 |
| ||
| ||
| ||
| ||
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去.试剂X是
A.食醋 B.氯化钡C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应.现取含Ca2+浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是
步骤一:配制500mL0.10mol/L硫代硫酸钠 (Na2S2O3)标准溶液.
(1)需要称取
A.称取硫代硫酸钠固体时,将硫代硫酸钠固体放在托盘天平右盘
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.未将洗涤烧杯内壁的溶液转入容量瓶
D.定容时俯视刻度线
E.定容时,不小心加水超过刻度线,立即用胶头滴管吸出多余的水
步骤二:取50.0mL自来水样品放入锥形瓶中,加入适量H2 SO4酸化,然后加入过量的KIO4,发生反应
2Mn2++5IO4-+3H2O═2MnO4-+5IO3-+6H+多余的KIO4通过加入掩蔽剂来消除干扰.再加入足量的KI溶液,使之与上述反应生成的MnO4-,IO3-反应,制得待测液.
(2)加入足量的KI溶液时,发生反应的离子方程式分别是:2MnO4-+10I-+16H+═2Mn2++5I2+8H2 O、
步骤三:用稀释至0.0010mol/L的硫代硫酸钠溶液滴定上述待测液,发生反应:I2+2Na2S2O3═2NaI+NaS4O6
达到滴定终点时消耗Na2S2O3溶液12.00mL
(3)滴定操作时,用