摘要:对反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4.下列结论正确的是( ) A.只有CuSO4作氧化剂 B.FeS2既是氧化剂又是还原剂 C.被氧化的硫和被还原的硫的质量之比为3:7 D.1molCuSO4可以氧化5/7mol硫元素
网址:http://m.1010jiajiao.com/timu3_id_349141[举报]
对于可逆反应N2(g)+3H2(g)?2NH3(g)△H<0,下列各项对示意图的解释与图象相符的是( )
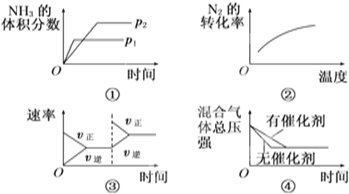

| A、①压强对反应的影响(p2>p1) | B、②温度对反应的影响 | C、③平衡体系增加N2对反应的影响 | D、④催化剂对反应的影响 |
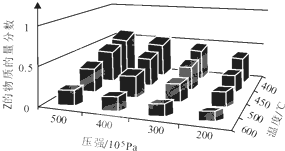 为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如右图所示.以下判断正确的是( )
为了探索外界条件对反应aX(g)+bY(g)?cZ(g)的影响,以X和Y物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如右图所示.以下判断正确的是( )| A、△H>0,a+b>c | B、△H>0,a+b<c | C、△H<0,a+b>c | D、△H<0,a+b<c |
Ⅰ.下列四支试管中,过氧化氢分解的化学反应速率最大的是
Ⅱ.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)实验①和②的目的是
(2)写出实验③的化学反应方程式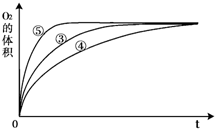
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析如图能够得出的实验结论是
查看习题详情和答案>>
c
c
| 试管 | 温度 | 过氧化氢浓度 | 催化剂 |
| a | 室温(25℃) | 12% | 有 |
| b | 水浴加热(50℃) | 4% | 无 |
| c | 水浴加热(50℃) | 12% | 有 |
| d | 室温(25℃) | 4% | 无 |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
探究浓度对反应速率的影响
探究浓度对反应速率的影响
.(2)写出实验③的化学反应方程式
2H2O2 O2↑+2H2O
O2↑+2H2O
 O2↑+2H2O
O2↑+2H2O2H2O2 O2↑+2H2O
O2↑+2H2O
. O2↑+2H2O
O2↑+2H2O
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析如图能够得出的实验结论是
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
.对于可逆反应N2(g)+3H2(g)?2NH3(g);△H<0,仅改变单一条件后,下列的选项和图示相符的是( )
A、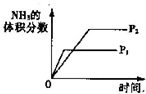 压强对反应的影响 | B、 温度对反应的影响 | C、 在平衡体系中增加N2对反应的影响 | D、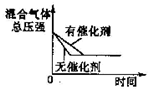 催化剂对反应的影响 |
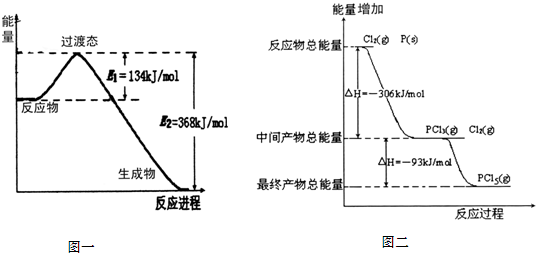
20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态.分析图(本题最下方)中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式
②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
查看习题详情和答案>>
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234KJ/mol
NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234KJ/mol
.在反应体系中加入催化剂,E1和E2的变化是:E1减小
减小
,E2减小
减小
(填“增大”、“减小”或“不变”),对反应热是否有影响?不变
不变
,原因是加入催化剂,改变反应的途径,降低反应所需的活化能
加入催化剂,改变反应的途径,降低反应所需的活化能
.(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据).根据图二回答下列问题:
①P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
P(s)+Cl2(g)═PCl3(g)△H=-306KJ/mol
.PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式
PCl5(g)═PCl3(g)+Cl2(g)△H=+93KJ/mol
PCl5(g)═PCl3(g)+Cl2(g)△H=+93KJ/mol
.②P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2
等于
等于
△H1(填“大于”、“小于”或“等于”),原因是反应中的能量变化只与起态、终态有关,与反应的途径无关
反应中的能量变化只与起态、终态有关,与反应的途径无关
.