摘要:解:设原溶液的质量为x克
网址:http://m.1010jiajiao.com/timu3_id_348286[举报]
A为中学化学常见金属单质,将A投入足量B的浓溶液中,溶液总质量在反应前后保持不变(忽略沉淀或气体的溶解).除A、C外其余各物质均含同一种元素X,F为X的氢化物,H为黑色沉淀
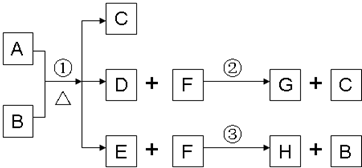
(1)纯净的B在固态时晶体类型为
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的化学方程式
(3)检验E中阴离子的操作方法为:
(4)国内工业用含W的矿石制备B,该反应在
 .
.
查看习题详情和答案>>

(1)纯净的B在固态时晶体类型为
分子晶体
分子晶体
,固态B熔化时克服的作用力类型是分子间作用力
分子间作用力
,写出反应①的化学反应方程式Cu+2H2SO4
CuSO4+SO2+2H2O
| ||
Cu+2H2SO4
CuSO4+SO2+2H2O
;
| ||
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的化学方程式
3S+6NaOH
2Na2S+Na2SO3+3H2O
| ||
3S+6NaOH
2Na2S+Na2SO3+3H2O
;
| ||
(3)检验E中阴离子的操作方法为:
向硫酸铜溶液中加入硝酸酸化的氯化钡,如果出现白色沉淀,证明有硫酸根,反之,则没有
向硫酸铜溶液中加入硝酸酸化的氯化钡,如果出现白色沉淀,证明有硫酸根,反之,则没有
;(4)国内工业用含W的矿石制备B,该反应在
沸腾炉
沸腾炉
(填设备名称)中进行.写出燃烧W的化学方程式,并标出电子转移的方向和数目.

A为中学化学常见金属单质,将A投入足量B的浓溶液中,溶液总质量在反应前后保持不变(忽略沉淀或气体的溶解).除A、C外其余各物质均含同一种元素X,F为X的氢化物,H为黑色沉淀
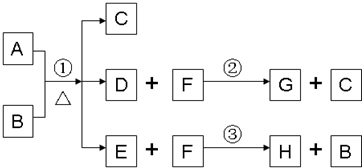
(1)纯净的B在固态时晶体类型为______,固态B熔化时克服的作用力类型是______,写出反应①的化学反应方程式______;
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的化学方程式______;
(3)检验E中阴离子的操作方法为:______;
(4)国内工业用含W的矿石制备B,该反应在______(填设备名称)中进行.写出燃烧W的化学方程式,并标出电子转移的方向和数目.______.
查看习题详情和答案>>
A为中学化学常见金属单质,将A投入足量B的浓溶液中,溶液总质量在反应前后保持不变(忽略沉淀或气体的溶解).除A、C外其余各物质均含同一种元素X,F为X的氢化物,H为黑色沉淀
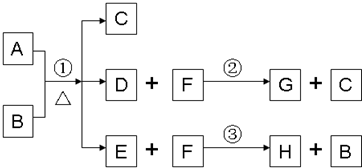
(1)纯净的B在固态时晶体类型为______,固态B熔化时克服的作用力类型是______,写出反应①的化学反应方程式______;
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的化学方程式______;
(3)检验E中阴离子的操作方法为:______;
(4)国内工业用含W的矿石制备B,该反应在______(填设备名称)中进行.写出燃烧W的化学方程式,并标出电子转移的方向和数目.______.
查看习题详情和答案>>

(1)纯净的B在固态时晶体类型为______,固态B熔化时克服的作用力类型是______,写出反应①的化学反应方程式______;
(2)G和过量NaOH溶液在加热时反应,氧化产物与还原产物的物质的量之比为1:2,写出该反应的化学方程式______;
(3)检验E中阴离子的操作方法为:______;
(4)国内工业用含W的矿石制备B,该反应在______(填设备名称)中进行.写出燃烧W的化学方程式,并标出电子转移的方向和数目.______.
依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示。
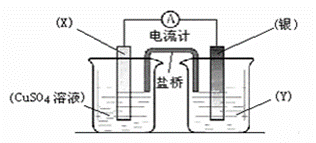
请回答下列问题:(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极,发生的电极反应为 ;
X电极上发生的电极反应为 ;
(3)当外电路有0.2mol的电子通过时,X电极的质量变化 克。
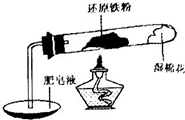 铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.
铁不能与冷、热水反应,但能与水蒸气反应.中学教材中用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验.资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4.
(1)实验中使用肥皂液的作用是
(2)甲同学对实验后试管内的黑色固体X含有哪些物质进行了探究.
提出假设:①所得固体是FeO
②所得固体是Fe3O4
③所得固体是
实验探究:
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,加入盐酸,微热. | 黑色粉末逐渐溶解,有少量气泡产生. |
| ② | 取试管1反应后的溶液少许,滴加几滴KSCN溶液,振荡. | 溶液没有出现血红色. |
| ③ | 取试管1反应后的溶液少许,滴加几滴酸性KMnO4溶液,振荡 | 高锰酸钾溶液褪色 |
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4.
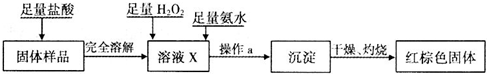
①溶液X中发生氧化还原反应的离子方程式为
②操作a包括过滤和洗涤,检验沉淀是否已经洗涤干净的操作是
③如果取固体样品m1克,反应后得到红棕色固体m2克,则m1与m2之比最少应大于