摘要:(八)比较微粒半径的大小 无论是原子还是离子半径.一般由原子核对核外电子的吸引力及电子间的排斥力的相对大小来决定.故比较微粒半径大小时只需考虑核电荷数.核外电子排斥情况.具体规律小结如下: 1. 核电荷数相同的微粒.电子数越多.则半径越大.即同种元素: 阳离子半径<原子半径<阴离子半径 如:H+<H<H-; Fe>Fe2+ >Fe3+ Na+<Na; Cl<Cl- 2. 电子数相同的微粒.核电荷数越多则半径越小.即具有相同电子层结构的微粒. 核电荷数越大.则半径越小.如: (1)与He电子层结构相同的微粒: H->Li+>Be2+ (2)与Ne电子层结构相同的微粒: O2->F->Na+>Mg2+>Al3+ (3)与Ar电子层结构相同的微粒: S2->Cl->K+>Ca2+ 3. 电子数和核电荷数都不同的微粒: (1)同主族的元素,无论是金属还是非金属,无论是原子半径还是离子半径从上到下递 增. (2)同周期:原子半径从左到右递减.如Na>Cl (3)同周期元素的离子半径比较时要把阴阳离子分开.同周期非金属元素形成的阴离子 半径大于金属元素形成的阳离子半径.如Na+<Cl- 如第三周期,原子半径最小的是Cl, 离子半径最小的是Al3+ (4)如既不是同周期,又不是同主族,比较原子半径时,要寻找到合适的中间者. 如Ge.P.O的半径大小比较.可找出它们在周期表中的位置.( )中元素为中间者. (N) O (Si) P Ge 因为Ge>Si>P>N>O,故Ge>P>O
网址:http://m.1010jiajiao.com/timu3_id_347972[举报]
(2012?青浦区二模)氮化硼(BN)是一种重要的功能陶瓷材料.以天然硼砂为起始物,经过一系列反应可以得到BN,如图所示:
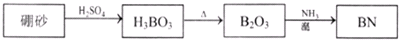
(1)①由B2O3制备BN的化学方程式是
②BN有二种结构,其中一种超硬、耐磨、耐高温,这种BN属于
(2)硼元素原子的电子排布式为
(3)与B元素在同一周期,其原子的最外层有2个未成对电子的元素是
(4)原子个数相同、最外层电子总数也相同的化合物是“等电子体”,等电子体的结构相似.B3N3H6与苯是等电子体,被称为“无机苯”.B3N3H6的结构式如图 ,则B3N3H6的二氯代物有
,则B3N3H6的二氯代物有
查看习题详情和答案>>

(1)①由B2O3制备BN的化学方程式是
B2O3+2NH3
2BN+3H2O
| ||
B2O3+2NH3
2BN+3H2O
.
| ||
②BN有二种结构,其中一种超硬、耐磨、耐高温,这种BN属于
原子
原子
晶体.(2)硼元素原子的电子排布式为
1s22s22p1
1s22s22p1
,这些电子有3
3
种不同的能量.(3)与B元素在同一周期,其原子的最外层有2个未成对电子的元素是
C、O
C、O
(写元素符号);甲同学列了一个比较微粒半径的式子:Li+>Be2+>B3+,乙同学对此提出了异议.乙同学的异议是B元素原子没有简单的阳离子
B元素原子没有简单的阳离子
.(4)原子个数相同、最外层电子总数也相同的化合物是“等电子体”,等电子体的结构相似.B3N3H6与苯是等电子体,被称为“无机苯”.B3N3H6的结构式如图
 ,则B3N3H6的二氯代物有
,则B3N3H6的二氯代物有4
4
种(选填编号).根据周期律对角线规则,金属Be与铝单质及其化合物的性质相似.又知AlCl3熔、沸点较低,易升华,熔融状态不导电,试回答:
(1)比较Be2+、Li+、H+ 微粒半径的大小:
(2)写出BeO与NaOH溶液反应的离子方程式(生成Na2BeO2):
(3)Be(OH)2、Mg(OH)2可用试剂
(4)BeCl2是
查看习题详情和答案>>
(1)比较Be2+、Li+、H+ 微粒半径的大小:
由大到小依次是
Li+、Be2+、H+
Li+、Be2+、H+
由大到小依次是
Li+、Be2+、H+
;Li+、Be2+、H+
(2)写出BeO与NaOH溶液反应的离子方程式(生成Na2BeO2):
BeO+2OH-=BeO2-+H2O
BeO+2OH-=BeO2-+H2O
;(3)Be(OH)2、Mg(OH)2可用试剂
NaOH溶液
NaOH溶液
鉴别,其离子方程式为Be(OH)2+2OH-=BeO22-+2H2O
Be(OH)2+2OH-=BeO22-+2H2O
;(4)BeCl2是
共价
共价
化合物(填“离子”或“共价”).