摘要:22.能源问题是我国面临的重大课题.甲醇属于再生能源.发展前景非常乐观. (1)在25℃.101kPa下.1g甲醇燃烧生成CO2和液态水时放热22.68kJ.请写出表示甲醇燃烧热的热化学方程式 . (2)以甲醇为燃料可以设计甲醇燃料电池(电极材料均为惰性电极.KOH溶液作电解质溶液).电池反应与甲醇燃烧反应相似.其正极反应式为:3O2+12e-+6H2O=12OH- .则负极反应式为 .
网址:http://m.1010jiajiao.com/timu3_id_34792[举报]
 能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1
反应II:CO(g)+2H2(g)?CH3OH(g)△H2
下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
<
<
0(填“>”、“<”或“=”),②若容器容积不变,下列措施可增加甲醇产率的是
BE
BE
,A.升高温度 B.将CH3OH(g)从体系中分离 C.使用合适的催化剂
D.充入He,使体系总压强增大 E.按原比例再充入 CO和 H2
③某温度下,将2mol CO和6mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol?L-1,则CO的转化率为
80%
80%
,此时的温度为250°C
250°C
(从上表中选择);④恒温下,1mol CO和nmol H2在一个容积可变的密闭容器中反应达到平衡后,生成a molCH3OH.若起始时放入3molCO+3nmolH2,则达平衡时生成CH3OH
3a
3a
mol.(2)某实验小组依据甲醇燃烧的反应原理,设计如图所示的原电池装置.
①该电池工作时,OH-向
负
负
极移动(填“正”或“负”),②该电池正极的电极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.(2013?浦东新区一模)能源短缺是人类面临的重大问题之一.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上合成甲醇一般采用以下反应:CO(g)+2H2(g)?CH3OH(g)+Q
下表所列数据是上述反应在不同温度下的化学平衡常数(K)
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应,5分钟后测得c(H2)=1.5mol/L,则此段时间内的反应速率(用CH3OH表达)
(2)由表中数据分析可知,Q
(3)在体积一定的密闭容器中,能说明该反应已处于化学平衡状态的是
a.V正(CO)=1/2V正(H2) b.混合气体的密度保持不变
c.反应体系中的热效应不再变化 d.c(CO):c(CH3OH)=1:1
(4)寻找到合适的催化剂是实现反应工业化的关键.该反应使用催化剂无法实现的目标是
a.提高单位时间内甲醇的产量 b.增大混合气体中甲醇的体积分数
c.缩短达到平衡所需时间 d.提高一氧化碳的转化率.
查看习题详情和答案>>
下表所列数据是上述反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
0.15
0.15
mol/(L?min).(2)由表中数据分析可知,Q
>
>
0(填“>”、“<”或“=”).其它条件不变的情况下,若压缩容器的体积,则平衡向正反应方向
向正反应方向
移动(“向正反应方向”“向逆反应方向”或“不”),化学平衡常数K不变
不变
(填“增大”、“减小”或“不变”).(3)在体积一定的密闭容器中,能说明该反应已处于化学平衡状态的是
c
c
(填编号).a.V正(CO)=1/2V正(H2) b.混合气体的密度保持不变
c.反应体系中的热效应不再变化 d.c(CO):c(CH3OH)=1:1
(4)寻找到合适的催化剂是实现反应工业化的关键.该反应使用催化剂无法实现的目标是
bd
bd
(填编号).a.提高单位时间内甲醇的产量 b.增大混合气体中甲醇的体积分数
c.缩短达到平衡所需时间 d.提高一氧化碳的转化率.
 (2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=_1275.6kJ?mol-1
②H2O(l)═H2O(g)△H=+44.0kJ.mol-1
写出表示甲醇燃烧热的热化学方程式:
CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol
| 3 |
| 2 |
CH3OH(g)+
O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol
.| 3 |
| 2 |
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1
反应B:CO(g)+2H2(g)?CH3OH(g)△H2
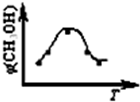
取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇的反应的△H1
<
<
0(填“>”、“<”或“=”).②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是
BD
BD
.A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
③某温度下,将4mol CO和12mol H2,充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.5mol?L-1,则该温度下该反应的平衡常数为
0.33
0.33
.④.某种甲醇-空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液.其工作时负极的电极反应式可表示为
CH3OH-6e-+H2O=6H++CO2↑
CH3OH-6e-+H2O=6H++CO2↑
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1:1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥,则该反应的化学方程式为
12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3
12NH3+3O2+4SO2+4NO2+6H2O=4(NH4)2SO4+4NH4NO3
.(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则溶液中c(Na+)+c(H+)
<
<
c(NO3-)+c(OH-)(填写“>”“=”或“<”)能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)?CH3OH(g)+Q1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q2
下表所列数据是反应I在不同温度下的化学平衡常数(K)
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应I,5分钟后测得c(CO)=0.2mol/L,计算此段时间的反应速率(用H2表达) mol/(L?min).
(2)由表中数据判断Q1 0(填“>”、“<”或“=”).
(3)若容器容积不变,下列措施可提高反应I中CO转化率的是 (选填编号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.原料气循环使用
(4)写出反应Ⅱ的平衡常数表达式:K= ;由于CO2化学惰性很大,因此找到合适的催化剂是实现该反应工业化的关键.该反应使用催化剂无法达到的效果是 (选填编号).
a.提高甲醇的单位时间产量 b.提高CO2的转化率 c.缩短达到平衡所需时间.
查看习题详情和答案>>
反应I:CO(g)+2H2(g)?CH3OH(g)+Q1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q2
下表所列数据是反应I在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(2)由表中数据判断Q1
(3)若容器容积不变,下列措施可提高反应I中CO转化率的是
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.原料气循环使用
(4)写出反应Ⅱ的平衡常数表达式:K=
a.提高甲醇的单位时间产量 b.提高CO2的转化率 c.缩短达到平衡所需时间.
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1
反应Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”),
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
I.由表中数据判断△H2 0(填“>”、“<”或“=”).
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是 (填序号).
A.升高温度 B.将CH3OH(g)从体系中分离出来 C.使用合适的催化剂
D.充入He,使体系总压强增大 E.按原比例再充入CO和H2
Ⅲ.
某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol?L-1,则CO的转化率为 ,此时的温度为 (从上表中选择);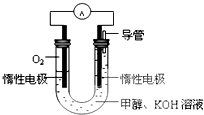
(2)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的原电池装置.
①该电池工作时,OH-向 极移动(填“正”或“负”),
②该电池正极的电极反应式为 .
查看习题详情和答案>>
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1
反应Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H2
①上述反应符合“原子经济”原则的是
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
I.由表中数据判断△H2
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离出来 C.使用合适的催化剂
D.充入He,使体系总压强增大 E.按原比例再充入CO和H2
Ⅲ.
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

(2)某实验小组依据甲醇燃烧的反应原理,设计如右图所示的原电池装置.
①该电池工作时,OH-向
②该电池正极的电极反应式为