摘要:烃的主要反应: 典型例题分析: 例1:(1)由2个C原子.1个O原子.1个N原子和若干个H原子组成的共价化合物.H的原子数目最多有 个.试写出其中一例的结构简式: . (2)若某共价化合物分子中只含有C.N.H三种元素.且以n分别表示C和N的原子数目.则氢原子数目最多等于 . (3)若某共价化合物分子中只含有C.N.O.H四种元素.且以n分别表示C.N和O的原子数目.则H原子数目最多等于 . 例2:某期刊封面上有如下一个分子的球棍模型图.图中“棍 代表单键或双键或三键.不同颜色的球代表不同元素的原子.该模型图可代表一种: A.卤代羟酸 B.酯 C.氨基酸 D.醇钠 例3:下列分子中所有碳原子肯定在同一平面上的是: A.CH3CH=CHCH3 B.CH3CH2CH2CH3 C. D.CH3C≡C-C≡C-CH3 例4:按系统命名法填写下列有机物的名称及有关内容: (1).名称是 . (2).名称是 .1mol该烃完全燃烧.需消耗氧气 mol. 例5:某气态烃1mol最多能与2mol氯化氢发生加成反应.所得产物又能与8mol氯气发生取代反应.最后得到一种只含碳氯元素的化合物.则原气态烃为: A.1-丁炔 B.2-戊炔 C.异戊二烯 D.辛炔 例6:为探究乙快与溴的加成反应.甲同学设计并进行如下实验:先取一定量工业用电石与水反应.将生成的气体通入溴水中.发现溶液褪色.即证明乙快与溴水发生了加成反应.乙同学发现在甲同学的实验中.褪色后的溶液里有少许淡黄色的浑浊.推测在制得的乙快中还可能含有少量还原性的杂质气体.由此他提出必须除去之.再与溴水反应. (1)写出甲同学实验中的两个主要的化学反应方程式 . (2)甲同学设计的实验 验证乙快与溴发生加成反应.其理由是 . A.使溴水褪色的反应.未必是加成反应 B.使溴水褪色的反应.就是加成反应 C.使溴水褪色的物质.未必是乙快 D.使溴水褪色的物质.就是乙快 (3)乙同学推测此乙快中必定含有一种杂质气体是 .它与溴水反应的化学方程式是 ,在验证过程中必须全部除去. (4)请你选用下列四个装置实现乙同学的实验方案.将它们的编号填入方框.并在括号中写出装置内所放的化学药品. (5)为验证这一反应是加成而不是取代.丙同学提出可用pH试纸来测试反应后溶液的酸性.理由是 . 课堂练习:
网址:http://m.1010jiajiao.com/timu3_id_347807[举报]
不对称烯烃和某些化合物加成时,氢原子主要加到含氢较多的不饱和碳原子上.试完成下列物质发生加成反应时的主要反应的化学方程式:
(1)CH3—CH![]() CH2和H2O:________________________________________________;
CH2和H2O:________________________________________________;
(2)![]() ________________________________________.
________________________________________.
查看习题详情和答案>>
 (2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.
(2013?朝阳区一模)燃煤产生的烟气中的氮氧化物NOx(主要为NO、NO2)易形成污染,必须经脱除达标后才能排放.(1)用化学方程式表示NO形成硝酸型酸雨的反应
2NO+O2═2NO2、3NO2+H2O═2HNO3+NO
2NO+O2═2NO2、3NO2+H2O═2HNO3+NO
(2)能作脱除剂的物质很多,下列说法正确的是
ab
ab
a.用 H2O作脱除剂,不利于吸收含氮烟气中的NO
b.用 Na2SO3作脱除剂,O2会降低Na2SO3的利用率
c.用CO作脱除剂,会使烟气中NO2的浓度增加
(3)尿素[CO(NH2)2]在一定条件下能有效将NOx转化为N2.
Ⅰ.已知可通过下列方法合成尿素:
2NH3(g)+CO2(g)?H2NCOONH4(s)△H=-159.5kJ/mol
H2NCOONH4(s)?CO(NH2)2(s)+H2O(l)△H=+28.5kJ/mol
①尿素释放出NH3的热化学方程式是
CO(NH2)2(s)+H2O(l)?2NH3(g)+CO2(g)△H=+131kJ/mol
CO(NH2)2(s)+H2O(l)?2NH3(g)+CO2(g)△H=+131kJ/mol
②写出有利于尿素释放NH3的条件并说明理由
升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行
升高温度;升高温度有利于平衡向吸热反应方向进行,同时温度升高,氨气的溶解度降低,均有利于向释放氨气的方向进行
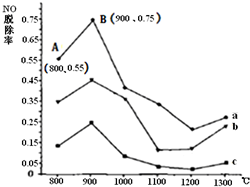
Ⅱ.CO(NH2)2与某种烟气(主要为N2、NO和O2)中的NO的物质的量比值分别为1:2、2:1、3:1时,NO脱除率随温度变化的曲线如图:
①曲线a 对应CO(NH2)2 与NO的物质的量比值是
3:1
3:1
.②曲线a、b、c中,800℃~900℃区间内发生主要反应的化学方程式是
4NH3+6NO═5N2+6H2O或2CO(NH2)2+6NO═2CO2+4H2O+5N2
4NH3+6NO═5N2+6H2O或2CO(NH2)2+6NO═2CO2+4H2O+5N2
.③900℃~1200℃区间内脱除率下降,NO浓度上升.发生的主要反应是
4NH3+5O2═4NO+6H2O
4NH3+5O2═4NO+6H2O
.④曲线a中,NO的起始浓度为6×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
1.5×10-4
1.5×10-4
mg/(m3?s).
工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
回答下列问题:
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的离子方程式为 .
(2)调节pH时不用氢氧化钠原因是: ,理论上,调节pH的最小值为 ,滤渣B的主要成分是 .
(3)加入MnS的目的是除去 杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 .回收废旧碱性锰电池中的锰,可向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止,其主要反应为:2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O,该方法的优点是 .
查看习题详情和答案>>

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表.
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Mn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的离子方程式为
(2)调节pH时不用氢氧化钠原因是:
(3)加入MnS的目的是除去
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为
(2013?滨州一模)反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
查看习题详情和答案>>
实验室用如图所示的流程进行气体性质实验.图中用箭头表示气体的流向,A为一种纯净、干燥的气体,B是另一种气体,己中有红棕色气体出现.实验中所用的药品只能从下列物质中选取:Na2CO3、NaHCO3、Na2O、Na2O2、NaCl、无水CaCl2、(NH4)2CO3、碱石灰等固体和蒸馏水.
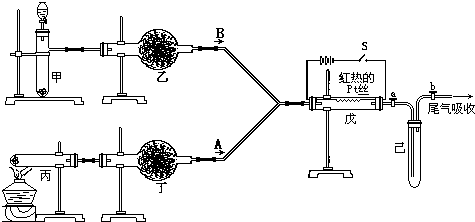
根据图中装置和现象回答:
(1)丙中发生反应的化学方程式为
(2)丁中应选用的干燥剂是
(3)甲中发生反应的化学方程式
(4)戊中发生的主要反应的化学方程式
查看习题详情和答案>>

根据图中装置和现象回答:
(1)丙中发生反应的化学方程式为
(NH4)2CO3
2NH3↑+CO2↑+H2O
| ||
(NH4)2CO3
2NH3↑+CO2↑+H2O
.
| ||
(2)丁中应选用的干燥剂是
碱石灰
碱石灰
,为什么不选用所给的另一种干燥剂因为另一种干燥剂的无水CaCl2,只能吸收水,不能吸收CO2,不能使氨气完全净化
因为另一种干燥剂的无水CaCl2,只能吸收水,不能吸收CO2,不能使氨气完全净化
.(3)甲中发生反应的化学方程式
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
.(4)戊中发生的主要反应的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.此反应是吸热反应还是放热反应
| ||
| △ |
放热反应
放热反应
,估计可看到什么现象足以说明你的判断戊中铂丝比开始反应时更加红热
戊中铂丝比开始反应时更加红热
.