摘要:下列四种溶液中.①pH=0的盐酸,②0.1mol/L的盐酸,③0.01mol/L NaOH溶液,④pH=11 NaOH溶液.由水电离生成的氢离子浓度之比是 A.1∶10∶100∶1000 B.0∶1∶12∶11 C.14∶13∶12∶11 D.14∶13∶2∶3
网址:http://m.1010jiajiao.com/timu3_id_347337[举报]
现有浓度均为0.1mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵
请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是
(3)已知t℃,KW=1×10-13,则t℃
(4)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=
②若x+y=13,则a/b=
③若x+y>14,则a/b=
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为
查看习题详情和答案>>
请回答下列问题:
(1)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
④②③①
④②③①
.(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是
c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+)
c(Na+)=c(Cl-)>c(OH-)>c(NH4+)>c(H+)
.(3)已知t℃,KW=1×10-13,则t℃
>
>
(填“>”、“<”或“=”)25℃.在t℃时将pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a:b=101:9
101:9
.(4)25℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=
1
1
(填数据);②若x+y=13,则a/b=
0.1
0.1
(填数据);③若x+y>14,则a/b=
10x+y-14
10x+y-14
(填表达式);④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为
x+y=14+lg(
)
| a |
| b |
x+y=14+lg(
)
(填表达式).| a |
| b |
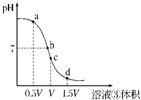 常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水试回答下列问题:
(1)上述溶液中有水解反应发生的是
①②
①②
(填编号,下同),溶液中溶质存在电离平衡的是②④
②④
;(2)比较①、②溶液,pH值较大的是
①
①
;(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将
变大
变大
(填“变小”、“变大”或“不变”);(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是
c
c
点,理由是恰好完全反应生成氯化铵溶液时,铵根离子水解显酸性,促进水的电离,酸过量或碱过量对水的电离起到抑制作用
恰好完全反应生成氯化铵溶液时,铵根离子水解显酸性,促进水的电离,酸过量或碱过量对水的电离起到抑制作用
;②a点溶液中离子浓度大小关系是
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
c(NH4+)>c(Cl-)>c(OH-)>c(H+)
;③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是
C(Cl-)=c(NH4+)+C(Na+)
C(Cl-)=c(NH4+)+C(Na+)
.
(1)常温下100mL 0.1mol?L-1 H2C2O4(草酸,也叫乙二酸)溶液pH=2,
①将它稀释10倍后,溶液pH 3(填“<”、“>”或“=”),此时同体积0.01mol?L-1稀盐酸与其分别和足量锌反应,稀盐酸放出氢气的体积 (填“多”、“少”或“相等”);
②向其中加少量草酸钠固体,以下数据增大的是 .
A.c(H2C2O4) B.c(OH-) C.水的离子积D.溶液导电性
(2)现有下列四种溶液:①0.01mol/L的CH3COOH溶液、②pH=2的稀盐酸、③pH=12的石灰水、④0.01mol/L的KOH溶液.其中水的电离程度最大的是 (填编号),若将pH=2的醋酸溶液与③溶液等体积混合,所得溶液pH 7(填“<”、“>”或“=”).
查看习题详情和答案>>
①将它稀释10倍后,溶液pH
②向其中加少量草酸钠固体,以下数据增大的是
A.c(H2C2O4) B.c(OH-) C.水的离子积D.溶液导电性
(2)现有下列四种溶液:①0.01mol/L的CH3COOH溶液、②pH=2的稀盐酸、③pH=12的石灰水、④0.01mol/L的KOH溶液.其中水的电离程度最大的是
常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是______(填编号,下同),溶液中溶质存在电离平衡的是______;
(2)比较①、②溶液,pH值较大的是______;
(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将______(填“变小”、“变大”或“不变”);
(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是______点,理由是______;
②a点溶液中离子浓度大小关系是______;
③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是______.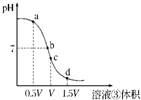
查看习题详情和答案>>
试回答下列问题:
(1)上述溶液中有水解反应发生的是______(填编号,下同),溶液中溶质存在电离平衡的是______;
(2)比较①、②溶液,pH值较大的是______;
(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将______(填“变小”、“变大”或“不变”);
(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是______点,理由是______;
②a点溶液中离子浓度大小关系是______;
③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是______.

常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是______(填编号,下同),溶液中溶质存在电离平衡的是______;
(2)比较①、②溶液,pH值较大的是______;
(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将______(填“变小”、“变大”或“不变”);
(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是______点,理由是______;
②a点溶液中离子浓度大小关系是______;
③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是______.
 查看习题详情和答案>>
查看习题详情和答案>>
试回答下列问题:
(1)上述溶液中有水解反应发生的是______(填编号,下同),溶液中溶质存在电离平衡的是______;
(2)比较①、②溶液,pH值较大的是______;
(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将______(填“变小”、“变大”或“不变”);
(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是______点,理由是______;
②a点溶液中离子浓度大小关系是______;
③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是______.
 查看习题详情和答案>>
查看习题详情和答案>>