网址:http://m.1010jiajiao.com/timu3_id_347257[举报]
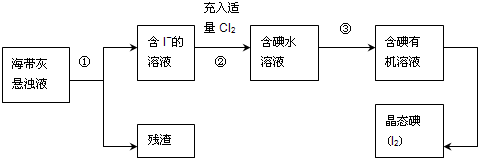
(1)灼烧海带时需要用到的实验仪器是______(从下列仪器中选出所需的仪器,用标号字母填写在空白处).
A.烧杯B.坩锅C.表面皿D.铁架台(带铁圈)E.酒精灯F.干燥器
(2)指出提取碘的过程中有关的实验操作名称:①______,③______;
(3)过程②中充入适量Cl2的目的是______;
(4)操作③中所用的有机试剂可以是______(只填一种),简述选择其理由______.
(5)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层.
a.上述G步操作的目的是:______;
b.最后碘的有机溶液是通过______获得(填“漏斗上口”或“漏斗下口”).
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:______.
(7)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置指出其错误之处并加以改正______;?
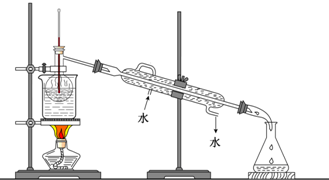
(8)进行上述蒸馏操作时,使用水浴的原因是______,最后晶态碘在______里聚集.
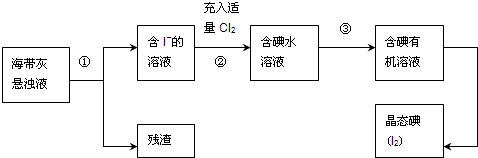
(1)灼烧海带时需要用到的实验仪器是
A.烧杯 B.坩锅 C.表面皿 D.铁架台(带铁圈) E.酒精灯 F.干燥器
(2)指出提取碘的过程中有关的实验操作名称:①
(3)过程②中充入适量Cl2的目的是
(4)操作③中所用的有机试剂可以是
(5)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂(你所选的)加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层.
a.上述G步操作的目的是:
b.最后碘的有机溶液是通过
(6)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
(7)从含碘的有机溶液中提取碘和回收有机溶液,还需要经过蒸馏,观察如图所示实验装置指出其错误之处并加以改正
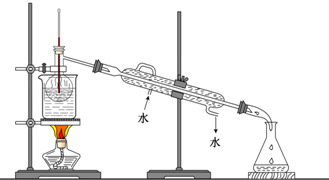
(8)进行上述蒸馏操作时,使用水浴的原因是
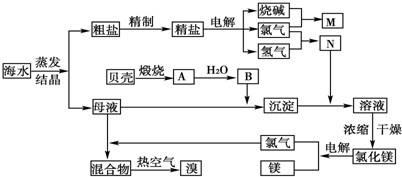
请回答:
(1)在粗盐中含有Ca2+、Mg2+、Fe3+、SO
2- 4 |
(2)氯碱工业为高耗能产业,一种用电解池燃料电池相结合的新工艺可节能30%.如图为工艺设计简图,根据图示回答以下问题:
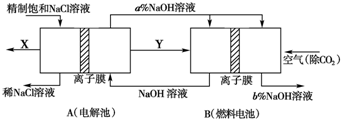
a.写出燃料电池中负极的电极反应式
b.比较NaOH溶液的浓度a
(3)Mg(OH)2中加入盐酸后,要获得MgCl2?6H2O晶体,按所需的实验操作依次为
a.蒸馏 b.灼烧 c.过滤
d.在HCl气流中蒸发 e.冷却结晶
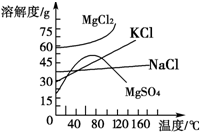
(4)母液中常含有MgCl2、NaCl、MgSO4、KCl等(其溶解度与温度的关系如图所示),可进一步加工制得一些重要的产品.若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是
(5)在母液中通入足量的Cl2,然后用热空气将Br2吹出,再用SO2吸收,写出此过程发生反应的化学反应方程式
(1)提出假设:A是FeCl3,B是FeCl2。
(2)设计实验方案:分别取A、B的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。
实验方法 | 实验现象 | 结论 |
分别向A、B溶液中加KSCN溶液 | ________ | 固体物质中有FeCl3 |
分别向KMnO4溶液中加适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含_______ |
(3)根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式:___________________。
(4)为进一步探究FeCl3溶液的性质,他又利用A溶液做了如下一些实验,其中明显错误的是____________________________________________________________________。
A.将A溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在A溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将A溶液加热蒸干并灼烧,得到FeCl3固体
(5)实际应用:
FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有FeCl3、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化性由强到弱的顺序为:_______________。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。方案2中铜作 极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_____________。
方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:________________。
查看习题详情和答案>>