网址:http://m.1010jiajiao.com/timu3_id_347229[举报]
(12分)图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白: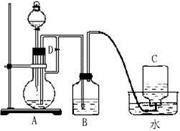
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是 。A中反应的离子方程式是 。
(2)实验开始时先应将活塞D (填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是 。
(3)简述生成Fe(OH)2的操作过程 。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式 。
(12分)图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白:

(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是 。A中反应的离子方程式是 。
(2)实验开始时先应将活塞D (填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是 。
(3)简述生成Fe(OH)2的操作过程 。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式 。
查看习题详情和答案>>
已知Fe(OH)2是白色难溶于水的物质,很容易被空气中的氧气氧化为Fe(OH)3。如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6mol/L的硫酸,其它试剂自选。
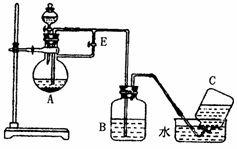
请填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是 ;
(2)实验开始时应先将活塞E (填“打开”或“关闭”),C中收集到的气体的主要成份是 ;
(3)简述生成Fe(OH)2的操作过程
;
(4)(3)操作后拔出装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式
。
查看习题详情和答案>>