摘要:(五)典型的图像分析及应用 以Al元素为核心的图像丰富多彩.析图或作图时不仅要注意加入酸或碱的强弱.而且要注意所加入的量或滴加顺序.正因滴加顺序不同可转产生的现象不同.故可用相互滴加法来临别试剂如 AlCl3 NaAlO2 NaOH HCl 若产生沉淀有多种.则应细细分析相关量间的关系.要持别关注沉淀是否同步完全.沉淀物是否溶于所加入的过量试剂中.同时要注意纵生标的物理量意义.对于一些复杂问题可先分解后组合.进行图像的叠加工作.抓住杂些关键点(如最高点.最低点.转折点)和变化趋势.才能较顺利地解决图像问题. 现将基本或重要的有关图像归纳如下: (1)含1molAlCl3的溶液中滴加NaOH (2)含1molAlCl3的溶液中通入NH3 (3)含1molNaOH的溶液中滴加AlCl3 (4)含1molNH3的氨水滴加AlCl3 (5)含1molNaAlO2的溶液中滴加HCl (6)含1molNaAlO3的溶液中通入CO2 (7)1molHCl溶液中滴加NaAlO2 (8)含各1molMg2+.Al3+混合液中滴加NaOH溶液 (9)含各1molMg2+.Al3+.NH4+混合液中滴加NaOH溶液 (10)含1molKAl(SO4)2的溶液中滴加Ba(OH)2溶液: A13+ - Ba(OH)2 -Al(OH)3 SO42- - Ba(OH)2 - BaSO4 Al(OH)3.BaSO4求能同步沉淀完全 mol mol mol ①当加入molBa(OH)2时 生成沉淀 1.0mol 78g BaSO4 1.5mol 349.5g 总 2.5mol 427.5g ②当加入Ba(OH)2 2mol时 Al(OH)3已完全溶解 BaSO4 2mol 总质量466g 图像如下:
网址:http://m.1010jiajiao.com/timu3_id_347217[举报]
| |||||||||||||||||||||||||||||
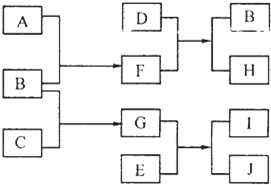 A、B、C、D、E是中学化学常见的单质,其中A、C常温下为气态,B、D、E是金属.E的摩尔质量是A的2倍,F、G、H、I、J五种化合物分别由组成上述五种单质中的两种元素组成.D与F反应放出大量的热.它们之间的转化关系如图所示(反应条件已省略);
A、B、C、D、E是中学化学常见的单质,其中A、C常温下为气态,B、D、E是金属.E的摩尔质量是A的2倍,F、G、H、I、J五种化合物分别由组成上述五种单质中的两种元素组成.D与F反应放出大量的热.它们之间的转化关系如图所示(反应条件已省略);请回答下列问题:
(1)元素B在周期表的位置是
(2)写出D与F反应的化学方程式:
(3)H是一种典型的
(4)若参加反应的E足量,生成的J中含有组成B的元素,则检验化合物J中阳离子的化学方法(有必要的文字叙述和相应的离子方程式)是:
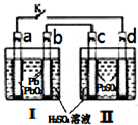 飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为:
飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为:Pb+PbO2+4H++2SO42-
| ||
| 充电 |
(1)当K闭合时,a电极的电极反应式是
PbO2+2e-+4H++SO42-=PbSO4+2H2O
PbO2+2e-+4H++SO42-=PbSO4+2H2O
;放电过程中SO42-向b
b
极迁移.当K闭合一段时间后,再打开K,Ⅱ可单独作为原电池使用,此时c电极的电极反应式为Pb-2e-+SO42-=PbSO4
Pb-2e-+SO42-=PbSO4
.(2)铅的许多化合物,色彩缤纷,常用作颜料,如铬酸铅是黄色颜料,碘化铅是金色颜料(与硫化锡齐名),室温下碘化铅在水中存在如下平衡:PbI2(S)?Pb2+(aq)+2I-(aq).
①该反应的溶度积常数表达式为Ksp=
c(Pb2+)?c2(I-)
c(Pb2+)?c2(I-)
.②已知在室温时,PbI2的溶度积Ksp=8.0×10-9,则100mL 2×10-3mol/L的碘化钠溶液中,加入100mL2×10-2mol/L的硝酸铅溶液,通过计算说明是否能产生PbI2沉淀
Qc=10-2?(10-3)2=10-8>Ksp,能产生PbI2沉淀
Qc=10-2?(10-3)2=10-8>Ksp,能产生PbI2沉淀
.③探究浓度对碘化铅沉淀溶解平衡的影响
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响.
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3饱和溶液、PbI2饱和溶液、PbI2悬浊液;
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子.
请填写下表的空白处:
| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①碘离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再加入少量NaI饱和溶液, 取PbI2饱和溶液少量于一支试管中,再加入少量NaI饱和溶液, |
溶液中出现黄色浑浊. 原因是溶液中c(I-)增大,使Qc大于了pbI2的Ksp 溶液中出现黄色浑浊. 原因是溶液中c(I-)增大,使Qc大于了pbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 |
黄色浑浊消失 原因是形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于了pbI2的Ksp 黄色浑浊消失 原因是形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于了pbI2的Ksp |
| ③ 铅离子和碘离子浓度都减小对平衡的影响 铅离子和碘离子浓度都减小对平衡的影响 |
在PbI2悬浊液中加入少量FeCl3饱和溶液 | PbI2 +2Fe3++4Cl-=PbCl42-+2Fe2++I2 PbI2 +2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
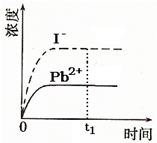 ④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图.
④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图.⑤至于碳酸铅,早在古代就被用作白色颜料.考古工作者发掘到的古代壁画或泥俑,其中人脸常是黑色的.经过化学分析和考证,证明这黑色的颜料是铅的化合物--硫化铅(已知PbCO3的
Ksp=1.46×10-13,PbS的Ksp=9.04×10-29)试分析其中奥妙
PbCO3的Ksp=1.46×10-13 >PbS的Ksp=9.04×10-29 故PbCO3与S2-接触时,转化为更难溶的黑色的PbS了
PbCO3的Ksp=1.46×10-13 >PbS的Ksp=9.04×10-29 故PbCO3与S2-接触时,转化为更难溶的黑色的PbS了
.苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒.降脂等药效,主要酸性物质为苹果酸.苹果酸在分离提纯后的化学分析如下:①相对分子质量不超过250,完全燃烧后只生成CO2和H2O,分子中C、H质量分数分别为w(C)=35.82%,w(H)=4.48%;②1mol该酸与足量的NaHCO3反应放出44.8L CO2,与足量的Na反应放出33.6L H2(气体体积均已折算为标准状况);③该分子中存在四种化学环境不同的碳原子,氢原子处于五种不同的化学环境.
回答下列问题:
(1)苹果酸的分子式为
(2)写出苹果酸的结构简式
 .
.
(3)苹果酸的同分异构体中,符合上述①、②两个条件的有(写出结构简式):
 、
、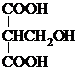
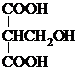 .
.
查看习题详情和答案>>
回答下列问题:
(1)苹果酸的分子式为
C4H6O5
C4H6O5
,分子中有2
2
个羧基.(2)写出苹果酸的结构简式


(3)苹果酸的同分异构体中,符合上述①、②两个条件的有(写出结构简式):


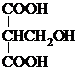
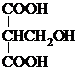
(2011?延庆县一模)A、B、C、D、E五种短周期元素,原子序数依次增大.A元素的单质是自然界最轻的气体,E单质须保存在煤油中.A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;
回答下列问题:
(1)N的电子式为
 ;M分子中含有
;M分子中含有
(2)D与E以1:1形成的化合物与水反应的化学反应方程式
(3)A、B、C、D可形成阳离子和阴离子个数比是1:1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1:2加热反应,写出反应的化学方程式
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质.则其负极反应为
(5)在一定温度下,将4mol C单质和12mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为
.从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质.
查看习题详情和答案>>
回答下列问题:
(1)N的电子式为


极性
极性
(填“极性”或“非极性”)键(2)D与E以1:1形成的化合物与水反应的化学反应方程式
2Na2O2+2CO2═2Na2CO3+O2↑
2Na2O2+2CO2═2Na2CO3+O2↑
(3)A、B、C、D可形成阳离子和阴离子个数比是1:1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1:2加热反应,写出反应的化学方程式
NH4HCO3+2NaOH
Na2CO3+NH3↑+2H2O
| ||
NH4HCO3+2NaOH
Na2CO3+NH3↑+2H2O
.反应后水溶液显
| ||
碱
碱
(填“酸”“碱”或“中”)性,原因是CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-CO32-+H2O HCO3-+OH-
HCO3-+OH-
(用离子方程式表示) HCO3-+OH-
HCO3-+OH-(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质.则其负极反应为
2NH3-6e-+6OH-═N2+6H2O
2NH3-6e-+6OH-═N2+6H2O
;一段时间后,溶液pH减小
减小
(填“增大”“减小”或“不变”).(5)在一定温度下,将4mol C单质和12mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为
0.5mol/L-1min-1
0.5mol/L-1min-1
;该温度下的平衡常数为K=| 4 |
| 27 |
| 4 |
| 27 |
a、c、e
a、c、e
(选填序号字母).a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质.
