摘要:17.4.72 18.(1)①3S+6OH -=2S 2 -+ +3H2O ②S 2 -+(x-1)S= ③ +S= ④2 +2(x+1)SO2+2OH-= +H2O a/3
网址:http://m.1010jiajiao.com/timu3_id_347172[举报]
将pH=3的硫酸溶液和pH=10的氢氧化钠溶液相混合,若要使混合后溶液的pH=7,则硫酸溶液和氢氧化钠溶液的体积比约为( )
A.1∶2 B.1∶10
C.1∶20 D.1∶9
查看习题详情和答案>>
将pH=3的硫酸溶液和pH=10的氢氧化钠溶液相混合,若要使混合后溶液的pH=7,则硫酸溶液和氢氧化钠溶液的体积比约为( )
A.1∶2 B.1∶10
C.1∶20 D.1∶9
查看习题详情和答案>>
(1)粗制的CuCl2?2H2O晶体中常含有Fe3+、Fe2+杂质.在提纯时,常先加入合适的氧化剂,将Fe2+氧化为Fe3+,下列可选用的氧化剂是
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
(2)己知:常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,㏒2=0.3.通常认为残留在溶液中的离子浓度小于1×10-5mol?L-1时就认为沉淀完全.试计算
①将溶液的pH调至PH=
②若CuSO4溶液的浓度为2.2mol?L-1,则Cu(OH)2开始沉淀时溶液的pH为
(3)调整溶液的pH可选用下列中的
A.NaOH(aq) B.NH3?H2O C.CuO粉末 D.Cu(OH)2悬浊液 E.Cu2(OH)2CO3(s)
查看习题详情和答案>>
BC
BC
.A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
(2)己知:常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,㏒2=0.3.通常认为残留在溶液中的离子浓度小于1×10-5mol?L-1时就认为沉淀完全.试计算
①将溶液的pH调至PH=
3.3
3.3
时Fe3+转化为Fe(OH)3而沉淀完全.②若CuSO4溶液的浓度为2.2mol?L-1,则Cu(OH)2开始沉淀时溶液的pH为
4
4
.(3)调整溶液的pH可选用下列中的
CDE
CDE
.A.NaOH(aq) B.NH3?H2O C.CuO粉末 D.Cu(OH)2悬浊液 E.Cu2(OH)2CO3(s)
在硫酸铝、硫酸和硫酸镁的混合溶液200mL中,c(SO42-)=0.80mol?L-1,当加入等体积1.6mol?L-1KOH溶液时,生成的沉淀最多,再加入过量的KOH溶液后,经过滤、洗涤、干燥,得到白色沉淀2.32g.则反应前的混合溶液中c(A13+)可能是( )
| A、0.20 mol?L-1 | B、0.40 mol?L-1 | C、0.80 mol?L-1 | D、1.20 mol?L-1 |
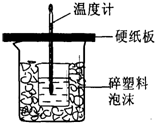 实验室用50mL0.50mol/L盐酸、50mL0.50mol/LNaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL0.50mol/L盐酸、50mL0.50mol/LNaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 |
起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
环形玻璃搅拌棒
环形玻璃搅拌棒
;实验时用该仪器搅拌溶液的方法是上下搅动
上下搅动
,由图可知该装置有不妥之处,应如何改正?应使小烧杯口与大烧杯口持平,其余部分用碎塑料填满
应使小烧杯口与大烧杯口持平,其余部分用碎塑料填满
.(2)反应需要多次测量温度,每次测量温度后都必须采取的操作是
用水将温度计上的液体冲掉,并擦干温度计
用水将温度计上的液体冲掉,并擦干温度计
.(3)已知Q=cm△t,经数据处理,则该实验测得的中和热△H=
-56.8kJ/mol
-56.8kJ/mol
(盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g?℃)计算).
(4)盐酸与氢氧化钠的中和热的文献值为-57.3kJ/mol,你认为(3)中测得的实验值偏差可能的原因是
①量热计的保温瓶绝热效果不好 ②酸碱溶液混合不迅速
①量热计的保温瓶绝热效果不好 ②酸碱溶液混合不迅速
(至少说出两点)(5)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1,则△H1与△H的关系为:△H1
>
>
△H(填“<”、“>”或“=”),理由是NH3?H2O电离吸热
NH3?H2O电离吸热
.