网址:http://m.1010jiajiao.com/timu3_id_346984[举报]
①不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体;
②为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液;
③用蒸馏水润湿的pH试纸测定溶液的pH一定有误差;
④向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH)3胶体;
⑤配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑥向饱和NaCl溶液中滴加浓硫酸制备HCl;
⑦亚硫酸钠与浓硫酸反应制备SO2;
⑧欲配制90mL 0.2mol?L-1 CuSO4溶液,需要称量CuSO4?5H2O的质量为4.5g.
| A、①②⑧ | B、①②⑦ | C、③④⑥ | D、⑤⑦⑧ |
实验二:取“实验一”配得的Mg Cl2溶液25.0mL,稀释到500mL.
(1)“实验一”所得MgCl2溶液的物质的量浓度为
(2)以上两个实验中除了用烧杯、量筒、胶头滴管外,还需要用到的玻璃仪器为
(3)配制“实验一”的溶液时,以下几个步骤:①量取;②计算;③溶解;④摇匀;⑤转移;⑥洗涤;⑦定容;⑧冷却.其正确操作顺序为
(4)“实验二”中下列操作可引起所配溶液浓度偏高的有
①洗涤量取MgCl2溶液的量筒,并将洗涤液转移到容量瓶中;
②量取MgCl2溶液时,俯视刻度线;
③转移前,容量瓶中含有少量蒸馏水;
④未洗涤稀释MgCl2溶液时用过的烧杯和玻璃棒;
⑤定容时,俯视刻度线.
下列实验操作或叙述正确的是 ( )
①不宜用瓷坩埚灼烧氢氧化钠或碳酸钠固体;
②为了提高纯锌与稀硫酸反应的速率,可向稀硫酸中滴入几滴CuSO4溶液;
③用蒸馏水润湿的pH试纸测定溶液的pH一定有误差;
④向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,可以制得Fe(OH)3胶体;
⑤配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑥向饱和NaCl溶液中滴加浓硫酸制备HCl;
⑦亚硫酸钠与浓硫酸反应制备SO2;
⑧欲配制90ml 0.2 mo1·L-1 CuSO4溶液,需要称量CuSO4·5H2O的质量为4.5g 。
|
A.①②⑧ |
B.①②⑦ |
C.③④⑥ |
D.⑤⑦⑧ |
查看习题详情和答案>>
实验二:取“实验一”配得的Mg Cl2溶液25.0mL,稀释到500mL.
(1)“实验一”所得MgCl2溶液的物质的量浓度为 ,“实验二”所得Mg Cl2溶液中Cl-的物质的量浓度为 .
(2)以上两个实验中除了用烧杯、量筒、胶头滴管外,还需要用到的玻璃仪器为 .
(3)配制“实验一”的溶液时,以下几个步骤:①量取;②计算;③溶解;④摇匀;⑤转移;⑥洗涤;⑦定容;⑧冷却.其正确操作顺序为 (填序号).
(4)“实验二”中下列操作可引起所配溶液浓度偏高的有 (填序号).
①洗涤量取MgCl2溶液的量筒,并将洗涤液转移到容量瓶中;
②量取MgCl2溶液时,俯视刻度线;
③转移前,容量瓶中含有少量蒸馏水;
④未洗涤稀释MgCl2溶液时用过的烧杯和玻璃棒;
⑤定容时,俯视刻度线. 查看习题详情和答案>>
纯碱中常含有少量的NaCl等杂质,下图仪器装置可用来测定纯碱中Na2CO3的质量分数。
图中:①空气②某溶液③纯碱④某溶液⑤碱石灰(注:碱石灰既能吸收CO2,又能吸收H2O)
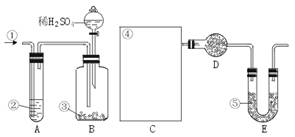 其实验步骤是:a.按上图所示,组装好实验仪器,并检查其气密性。b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g)。c.准确称量一定量的纯碱(设为n g),并将其放入广口瓶内。d.从分液漏斗中缓慢滴入一定量的稀硫酸,并从“1”处缓慢鼓入空气,直到B容器中不再产生气体为止。e.准确称量干燥管D的总质量(设为m2 g)。
其实验步骤是:a.按上图所示,组装好实验仪器,并检查其气密性。b.准确称量盛有碱石灰的干燥管D的质量(设为m1 g)。c.准确称量一定量的纯碱(设为n g),并将其放入广口瓶内。d.从分液漏斗中缓慢滴入一定量的稀硫酸,并从“1”处缓慢鼓入空气,直到B容器中不再产生气体为止。e.准确称量干燥管D的总质量(设为m2 g)。
根据上述实验回答下列问题:
(1)该实验进行到操作d时,要缓缓鼓入空气,其作用是____________________ 。装置A中盛装的液体“2”应选用________________,装置A的作用是________________,如果撤去装置A,直接向B中缓缓鼓入空气,则会导致实验测定结果(填“偏大”“偏小”或“不变”)________________。
(2)在空白格内画出装置C及试剂④是__________ ;装置C的作用是________________;如果撤去装置C,则会导致测定结果________________(填“偏大”“偏小”或“不变”)
(3)根据此实验,计算纯碱中Na2CO3的质量分数的数学式为________________(用m1、m2、n表示)
(4)装置E的作用是________________________。
查看习题详情和答案>>