摘要:22.如图19-4所示转化关系中.A-L均是中学化学中常见的物质.其中D为金属单质.B在常温常压下为无色液体,G为不溶于水但可溶于酸的白色固体,I为无色气体且能使湿润的红色石蕊试纸变蓝,L为无色气体.遇空气变为红棕色. 请回答: (1)构成单质D的元素在周期表中处于 周期. 族. (2)I物质的电子式为 .F物质的化学式为 ,它们的晶体类型分别为 . . (3)写出下列反应的化学方程式 ③ , ⑤ . (4)在反应⑤中如果有2mol J物质生成.则反应中转移的电子为 mol.
网址:http://m.1010jiajiao.com/timu3_id_346580[举报]
如图表示几种无机物之间的转化关系.其中A、B 均为黑色粉末,B为非金属单质,C 为无色无毒气体,D为金属单质,E 是红棕色气体,G 是具有漂白性的气体,H 的水溶液呈蓝色.
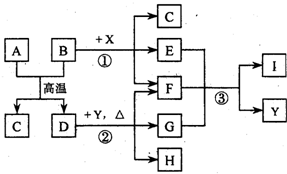
请回答下列问题:
(l) A 的化学式是 ,C 的电子式是 ,Y 的名称是 .
(2)反应①的化学方程式为 .
(3)实验室测定气体E 的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示) .
(4)用石墨作电极电解H 的水溶液,电解总反应的离子方程式是 .
(5)推测反应③的还原产物可能是 .
(6)19.2g的D与足量的一定浓度X的溶液反应,将所得的气体与 LO2(标准状况下)混合,恰好能被水完全吸收.
查看习题详情和答案>>

请回答下列问题:
(l) A 的化学式是
(2)反应①的化学方程式为
(3)实验室测定气体E 的相对分子质量时,得到的实验值总是比理论值偏大,其原因是(用化学方程式表示)
(4)用石墨作电极电解H 的水溶液,电解总反应的离子方程式是
(5)推测反应③的还原产物可能是
(6)19.2g的D与足量的一定浓度X的溶液反应,将所得的气体与
合成氨对化学工业和国防工业具有重要意义.
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图.

①图A中氨气的体积分数为15%时,H2的转化率为
②图B中T=450℃,则温度为500℃时对应的曲线是
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,一定温度下,在体积为2L的恒容容器中发生上述反应,各物质的物质的量变化如表:
①分析表中数据,判断5min时反应是否处于平衡状态?
②该温度下,上述反应的平衡常数K=
③反应在7~10min内,CO的物质的量减少的原因可能是
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④若第7分钟时将容器压缩至1L,请在图C所示坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线.
查看习题详情和答案>>
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图.

①图A中氨气的体积分数为15%时,H2的转化率为
24.46%
24.46%
.②图B中T=450℃,则温度为500℃时对应的曲线是
a
a
(填“a”或“b”).(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为
CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,一定温度下,在体积为2L的恒容容器中发生上述反应,各物质的物质的量变化如表:
| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | x1 | 0.80 | x2 | 0.60 |
| 7 | 0.20 | y1 | 0.20 | y2 |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
是
是
(填“是”或“否”),前5min反应的平均反应速率v(CH4)=0.02mol?L-1?min-1
0.02mol?L-1?min-1
.②该温度下,上述反应的平衡常数K=
0.0675
0.0675
.③反应在7~10min内,CO的物质的量减少的原因可能是
d
d
(填字母).a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④若第7分钟时将容器压缩至1L,请在图C所示坐标系中画出从第7分钟到第11分钟建立新平衡时甲烷浓度随时间的变化曲线.
(2013?德州模拟)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
①比较K1、K2的大小:K1
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是
a.υ(N2)正=3υ(H2)逆
b.容器内N2、H2、NH3的浓度之比为1:3:2
c.容器内压强保持不变
d.混合气体的平均相对分子质量保持不变
(2)298K时,1.00g N2H4(l)与足量的N2O4(l)完全反应生成氮气和液态水,放出19.15kJ的热量.写出该反应的热化学方程式
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收原料气中的CO,其反应是:
[Cu(NH3)2]Ac+CO+NH3?[Cu(NH3)3]Ac?C
<0
生产中必须除去原料气中CO的原因是
(4)对反应2NO2(g)?N2O4(g)△H<0在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是
a.A、C两点的反应速率:A>C
b.A、C两点NO2的转化率:A<C
c.B、C两点的气体的平均相对分子质量:B<C
d.由状态B到状态A,可以用加热的方法.
查看习题详情和答案>>
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| K | 4.1×106 | K1 | K2 |
>
>
K2填“>”、“=”或“<”);②若保持容器的容积不变,则该反应达到化学平衡状态的依据是
cd
cd
(填序号).a.υ(N2)正=3υ(H2)逆
b.容器内N2、H2、NH3的浓度之比为1:3:2
c.容器内压强保持不变
d.混合气体的平均相对分子质量保持不变
(2)298K时,1.00g N2H4(l)与足量的N2O4(l)完全反应生成氮气和液态水,放出19.15kJ的热量.写出该反应的热化学方程式
2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)△H=-1225.6KJ/mol
2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)△H=-1225.6KJ/mol
;(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收原料气中的CO,其反应是:

[Cu(NH3)2]Ac+CO+NH3?[Cu(NH3)3]Ac?C
| O |
生产中必须除去原料气中CO的原因是
防止催化剂中毒
防止催化剂中毒
;[Cu(NH3)2]Ac溶液吸收原料气中CO的适宜条件应是低温高压
低温高压
.(4)对反应2NO2(g)?N2O4(g)△H<0在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是
bd
bd
(填字母序号).a.A、C两点的反应速率:A>C
b.A、C两点NO2的转化率:A<C
c.B、C两点的气体的平均相对分子质量:B<C
d.由状态B到状态A,可以用加热的方法.