网址:http://m.1010jiajiao.com/timu3_id_34656[举报]
| ① | ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||||
| ⑦ | ⑩ | |||||||||||||||||||
| ⑾ | ⑧ | ⑨ | ||||||||||||||||||
a.是同一种核素 b.具有相同的中子数
c.几乎具有相同的化学性质 d.具有相同的物理性质
①与⑦具有相似的化学性质,写出①的氯化物水解反应的化学方程式
 Be(OH)2+2HCl
Be(OH)2+2HCl Be(OH)2+2HCl
Be(OH)2+2HCl(2)⑩和(11)两元素形成的某化合物可作为干燥剂,试写出其电子式


(3)③④⑤⑥四种元素氢化物的沸点由低到高排列为
(4)元素⑨X的单质和元素④Y的最高价氧化物的水化物反应的还原产物为YO和YO2,且YO和YO2的物质的量之比为1:1,写出该反应的化学方程式
(5)⑧号元素M形成的盐K2MO4是一种强氧化剂,可作为水处理剂和高容量电池的材料.与MnO2-Zn电池相似,K2MO4-Zn也可以组成碱性电池,其正极反应式为
(1)黄铁矿(FeS2,其中S为-1价)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2
 6SO2+Fe3O4,氧化产物为______,若有3mol FeS2参加反应,转移电子的物质的量为______.
6SO2+Fe3O4,氧化产物为______,若有3mol FeS2参加反应,转移电子的物质的量为______.(2)与明矾相似,硫酸铁也可用作净水剂.某自来水厂用氯气和绿矾
 一起净水,其原理为______(用离子方程式表示).
一起净水,其原理为______(用离子方程式表示).(3)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改 即可成为钢铁电化学防护的简单示意图,请在右图虚线框内作出修改,并用箭头标出电子流动方向.
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式______.
(4)高铁酸钾(K2FeO4)可用作净水剂,也可用于制造高铁电池.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为
3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH该电池放电时正极反应式为______.
用该电池电解100mL 1mol?L-1的AgNO3溶液,当电路中通过0.1mol 电子时,被电解
 溶液的pH为______(溶液体积变化忽略不计).
溶液的pH为______(溶液体积变化忽略不计).(5)氧化亚铜是一种半导体材料,常用作制造整流器的材料,还可以用于光照条件下水分解的催化剂和农作物的杀菌剂.
用右图装置可制得氧化亚铜,试写出阳极的电极反应式______.
查看习题详情和答案>>
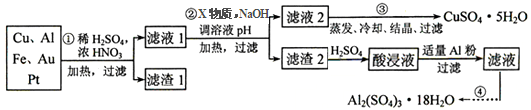
按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Fe2+ |
7.0 |
9.0 |
|
Fe3+ |
1.9 |
3.7 |
|
Cu2+ |
4.9 |
6.7 |
|
Al3+ |
3.0 |
4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
3Zn(OH)2
+ 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
查看习题详情和答案>>
电子产品产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
按要求回答下列问题:
(1)滤渣1中存在的金属有_____________。
(2)已知沉淀物的pH如下表:
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.7 |
| Cu2+ | 4.9 | 6.7 |
| Al3+ | 3.0 | 4.4 |
①则操作②中X物质最好选用的是___________(填编号)
a.酸性高锰酸钾溶液 b.漂白粉 c.氯气 d.双氧水
②理论上应控制溶液pH的范围是________________________。
(3)检验滤液2中既不存在Fe2+又不存在Fe3+的操作步骤是____________________。
(4)用一个离子方程式表示在酸浸液中加入适量铝粉的反应:___________________。
(5)由CuSO4·5H2O制备CuSO4时,应把CuSO4·5H2O放在______(填仪器名称)中加热脱水。
(6)现在某些电器中使用的高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4 + 8H2O
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
查看习题详情和答案>>
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,该电池放电时负极反应式为_______,每有1mol K2FeO4被还原,转移电子的物质的量为____,充电时阳极反应式为___________。
查看习题详情和答案>>