摘要:甲物质的1%的溶液与9%的溶液等体积混合.乙物质的1%的溶液与9%的溶液等体积混合后.根据表中数据判断下列叙述正确的是 A.混合后甲.乙溶液的质量分数均大于5% B.混合后乙溶液的质量分数大于5%.甲溶液的质量分数小于5% C.混合后甲溶液的质量分数大于5%.乙溶液的质量分数小于5% D.混合后甲.乙溶液的质量分数均等于5% 质量分数 溶液 密度/g·cm-3 甲的溶液 乙的溶液 1% 0.95 1.02 5% 0.92 1.04 10% 0.90 1.10
网址:http://m.1010jiajiao.com/timu3_id_346431[举报]
甲物质的溶质质量分数为1%溶液与9%溶液等体积混和,乙物质的溶质质量分数为1%溶液与9%溶液等体积混合,根据表中数据判断下列叙述正确的是( )
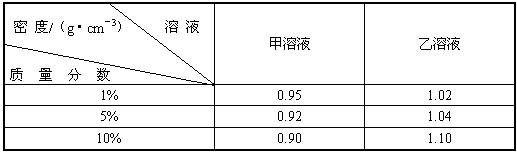
A.混合后,甲、乙溶液中的溶质的质量分数均大于5%
B.混合后,甲、乙溶液中溶质的质量分数均等于5%
C.混合后,甲溶液溶质的质量分数大于5%,乙溶液溶质的质量分数小于5%
D.混合后,甲溶液溶质的质量分数小于5%,乙溶液溶质的质量分数在于5%
查看习题详情和答案>>
甲物质的溶质质量分数为1%溶液与9%溶液等体积混和,乙物质的溶质质量分数为1%溶液与9%溶液等体积混合,根据表中数据判断下列叙述正确的是( )

A.混合后,甲、乙溶液中的溶质的质量分数均大于5%
B.混合后,甲、乙溶液中溶质的质量分数均等于5%
C.混合后,甲溶液溶质的质量分数大于5%,乙溶液溶质的质量分数小于5%
D.混合后,甲溶液溶质的质量分数小于5%,乙溶液溶质的质量分数在于5%
查看习题详情和答案>>
CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,以下是某兴趣小组对沉淀组成的探究.
提出假设:
假设1:沉淀为Cu (OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3?mCu (OH)2]
查阅资料:
无论是哪一种沉淀受热均易分解(假设均不含结晶水).
定性探究:
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;
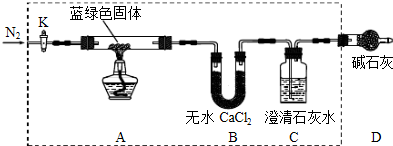
(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设 成立.
(2)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是 (填代号).
a.浓硫酸 b.无水CuSO4 c.碱石灰 d.P2O5
(3)乙同学更换B试剂后验证假设3成立的实验现象是 .
定量探究
(4)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是 (双选,填代号)
a.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为54.2g,实验结束后装置B的质量增加5.4g,C中的产生沉淀的质量为39.4g.则该蓝绿色固体的化学式为 .
查看习题详情和答案>>
提出假设:
假设1:沉淀为Cu (OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3?mCu (OH)2]
查阅资料:
无论是哪一种沉淀受热均易分解(假设均不含结晶水).
定性探究:
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;

(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设
(2)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是
a.浓硫酸 b.无水CuSO4 c.碱石灰 d.P2O5
(3)乙同学更换B试剂后验证假设3成立的实验现象是
定量探究
(4)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是
| 溶解度(S)/g | 溶度积(Ksp) | 摩尔质量(M)/g?mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为54.2g,实验结束后装置B的质量增加5.4g,C中的产生沉淀的质量为39.4g.则该蓝绿色固体的化学式为
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2
(3)丙组实验结果分析,HA是
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=
查看习题详情和答案>>
| 实验编号 | HA物质的量浓度 (mol?L-1) |
NaOH物质的量浓度 (mol?L-1) |
混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
a=7为强酸,a>7为弱酸
a=7为强酸,a>7为弱酸
.(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2
否
否
(选填“是”或“否”).混合液中离子浓度c(A-)与 c(Na+)的大小关系是c(A-)=c(Na+)
c(A-)=c(Na+)
.(3)丙组实验结果分析,HA是
弱
弱
酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
c(Na+)>c(A-)>c(OH-)>c(H+)
.(4)丁组实验所得混合溶液中由水电离出的c(OH-)=
10-5
10-5
mol?L-1.写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)-c(A-)=10-5-10-9
10-5-10-9
mol?L-1 c(OH-)-c(HA)=10-9
10-9
mol?L-1.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
请回答:
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2mol?L-1?
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算).
c(Na+)-c(A-)=
c(OH-)-c(HA)=
查看习题详情和答案>>
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:
若a=7,则HA是强酸;若a>7,则HA是弱酸
若a=7,则HA是强酸;若a>7,则HA是弱酸
.(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2mol?L-1?
否
否
(选填“是”或“否”).混合溶液中离子浓度c(A-)与c(Na+)的大小关系是C
C
.A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是
弱
弱
酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
c(Na+)>c(A-)>c(OH-)>c(H+)
.(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算).
c(Na+)-c(A-)=
10-5-10-9
10-5-10-9
mol?L-1;c(OH-)-c(HA)=
10-9
10-9
mol?L-1.