摘要:下列微粒的空间构型不是正四面体结构的是 ( ) A. NH4+ B. CF4 C. SiC D. PH3
网址:http://m.1010jiajiao.com/timu3_id_346339[举报]
下列叙述中,结论(事实)和对应的解释(事实)均不正确的是( )
| A、金刚石的熔沸点高于晶体硅,因为C-C键能大于Si-Si键能 | B、二氧化硅晶体中不存在SiO2分子,因为它含有硅氧四面体的空间网状结构 | C、稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力 | D、空间构型为正四面体结构的分子中,化学键的键角不一定是109°28′,有可能为60° |
在下列叙述中,结论(事实)和对应的解释(事实)均不正确的是
A.金刚石的熔沸点高于金刚砂(SiC) ,因为C—C键能大于C—Si键能
B.空间构型为正四面体的分子,其键角是![]() ,也可能为
,也可能为![]()
C.二氧化硅晶体中不存在SiO2分子,因为其晶体是含有硅氧四面体的空间网状结构
D.稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力
查看习题详情和答案>>已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是( )
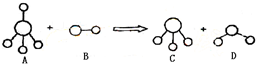
查看习题详情和答案>>

| A.分子C与D不能发生化学反应 |
| B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子 |
| C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键 |
| D.在25℃时,A的盐酸盐溶液的pH小于7 |

