摘要:有甲.乙两醋酸稀溶液.测得甲的pH=a.乙的pH=a+1.下列推断中正确的是 A.物质的量浓度c B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍 C.中和等物质的量浓度等体积的NaOH溶液需甲.乙两酸的体积V D.甲中的c(OH-)为乙中c(OH-)的10倍
网址:http://m.1010jiajiao.com/timu3_id_345664[举报]
常温下,有甲、乙两份体积均为lL,浓度均为0.1mol/L的氨水,其pH为11.①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol/L的盐酸混合,在混合溶液中:n(NH4+)+n(H+)-n(OH-)=bmol.则a、b正确的答案组合是( )
查看习题详情和答案>>
实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液.为测定甲、乙两瓶溶液的成分及物质的量浓度,进行以下实验:
①取25mL甲溶液,向其中缓慢滴入乙溶液15mL,共收集到112mL(标准状况)气体.
②取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到56mL(标准状况)气体.
(1)判断:甲是
(2)甲溶液的物质的量浓度为
查看习题详情和答案>>
①取25mL甲溶液,向其中缓慢滴入乙溶液15mL,共收集到112mL(标准状况)气体.
②取15mL乙溶液,向其中缓慢滴入甲溶液25mL,共收集到56mL(标准状况)气体.
(1)判断:甲是
HCl
HCl
溶液,乙是Na2CO3
Na2CO3
溶液;(均填化学式)(2)甲溶液的物质的量浓度为
0.4
0.4
mol/L,乙溶液的物质的量浓度为0.5
0.5
mol/L,(要求写出计算过程).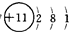
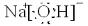
 (2012?闸北区二模)有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是( )
(2012?闸北区二模)有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06g Na2CO3和0.84g NaHCO3,试管中各有10mL相同浓度的盐酸(如图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是( )