网址:http://m.1010jiajiao.com/timu3_id_345587[举报]
快乐是什么?精神病学专家通过实验发现:在大脑的相应部位――“奖赏中心”给予柔和的电击,便会处于似乎极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并因为在各区域之间传递信息的物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。已知多巴胺的结构式为:
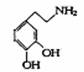
请回答下列问题:
(1)多巴胺的分子式为 。
(2)多巴胺可能发生的化学反应为 (填字母)
A.加成反应 B.取代反应 C.氧化反应 D.水解反应
(3)多巴胺可由香兰素与硝基甲烷反应后再经锌汞齐还原水解制得。合成过程可表示如下:
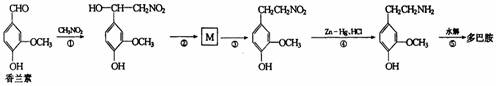
I.反应①属于 反应(填反应类型)
II.写出M的结构简式 。
III.多巴胺分子中羟基处于苯环上不同位置时的同分异构体共有 种(苯环上的其他结构不变)。
IV.写出反应⑤的化学方程式 。
查看习题详情和答案>>“上网成瘾”已成社会关注的问题。有研究发现,在大脑中存在相应部位――“奖赏中心”,长时间上网会使“奖赏中心”的化学物质多巴胺水平升高,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺分子中苯环上含有三个取代基,且不含甲基,相对分子质量不超过200。
⑴从多巴胺的名称推断,多巴胺分子结构中含有 官能团(填名称);该官能团中的中心原子的质量分数为9.15%,则多巴胺分子的摩尔质量为: 。
⑵已知多巴胺分子中氧元素的质量分数为20.9%,则多巴胺的分子式为 ,若多巴胺能与FeCl3发生显色反应,且苯环上只有相同取代基处于相邻位置,则多巴胺的结构简式为 ,多巴胺属于 (填字母编号)。
a. 氨基酸 b. 苯的同系物 c. 芳香族化合物 d. 芳香烃
⑶试判断多巴胺不应具有的化学性质 (填字母编号)。
a. 加成 b. 取代 c. 氧化 d. 水解
⑷已知多巴胺能与酸反应生成盐,写出多巴胺与足量溴水充分反应的化学方程式:
。
查看习题详情和答案>> 无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O)
无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另外一种固体.某学生将无水亚硫酸钠受热后的试样溶于水制成浓溶液,用下图所示的实验装置进行实验,他向试样溶液中缓缓地逐滴加入稀盐酸,根据实验现象判断固体试样含有什么成分?(已知:Na2 S+2HCl═2NaCl+H2S+SO2+2H2S═3S+2H2 O)(1)无水亚硫酸钠受热分解的化学方程式是
(2)如果加热温度在600℃以上,再向所得固体的试样溶液中缓缓滴加稀盐酸至足量,观察到CuSO4溶液中出现黑色沉淀,试分析其他装置中可能出现的现象.试样溶液:
(3)若加入了足量的稀盐酸后,品红溶液和CuSO4溶液中仍无明显的现象发生,原因是