网址:http://m.1010jiajiao.com/timu3_id_345535[举报]
 2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.
2009年12月7日一18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议.而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究.(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:
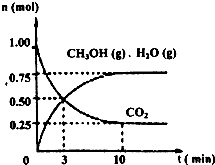
某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施中一定不能使n(CH3OH)/n(CO2)增大的是:
A.降低温度 B.缩小容器的容积 C.将水蒸气从体系中分离 D.使用更有效的催化剂
(2)常温常压下,饱和CO 2水溶液的pH=5.6,c(H2CO3)=1.5×l0-5mol?L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的电离平衡常数K=
(3)标准状况下,将1.12LCO2通入100mL 1mol?L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为
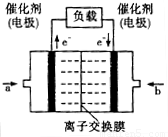
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示
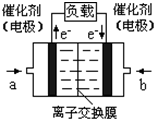 意图,则a处通入的是
意图,则a处通入的是b处电极上发生的电极反应是:
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
(1)制备纯净的硫酸铜称取15g粗CuSO4(含Fe2+)放入小烧杯中,加入50mL蒸馏水,搅拌.滴入少量稀硫酸,再滴加2mL3%的H2O2溶液,充分反应.将溶液冷却,逐滴加入0.5~1mol?L-1的NaOH溶液,直到pH=3.5~4,过滤,滤液转移到洁净的蒸发皿中,用稀硫酸将溶液pH调至1-2,再经蒸发、结晶、洗涤、晾干得精制的硫酸铜晶体(已知开始沉淀至沉淀完全的pH:Fe3+为2~3.7,Cu2+为4.7~6.7).
①加入酸化的过氧化氢溶液,发生反应的离子方程式为
②用NaOH溶液将溶液pH调至3.5~4,其目的是
(2)依据用(1)制得的精制硫酸铜晶体,制备高纯度的Cu(C1O4)2?6H2O,请补充实验
步骤.该实验可选用的试剂有:70%HClO4溶液,Na2CO3?1OH2O,盐酸酸化的氯化钡溶液.
a.称取7.0gCuSO4?5H2O和8.OgNa2CO3?10H2O,混合研细后,投入100mL沸水,快速搅拌,静置得绿色沉淀.
b.过滤,用少量蒸馏水洗涤沉淀
c.用
d.在沉淀中慢慢滴加70%HClO4溶液,搅拌至
e.过滤,得蓝色高氯酸铜溶液.f.在通风橱中蒸发至不再产生白雾,继续蒸发至有晶膜出现,冷却、结晶、过滤、洗涤,得蓝色晶体.
g.60℃下,在烘箱中干燥2h,得Cu(ClO4)2?6H2O晶体8.4g.
①补充上述步骤b、c和d.
②本次实验产率为_
③某温度下,高氯酸铜同时按两种方式分解:(A).Cu(ClO4)2═CuCl2+4O2↑(B).2Cu(ClO4)2═2CuO+7O2↑十+2Cl2↑
若测得V(O2)/V(Cl2)=n,则按(A)式分解的高氯酸铜的质量分数为
| 2n-7 |
| 2n+1 |
| 2n-7 |
| 2n+1 |
| A、若为恒容容器,当a:b:c为2:2:1时,平衡不移动 | B、若为恒容容器,当a:b=9:10,且c=0时,达平衡后,A、B、C物质的量之比仍为2:2:1 | C、若为恒压容器,当a:b为9:10,c为任意值时,平衡后A的质量分数一定仍为w% | D、若为恒压容器,当a=b=0,且c为任意值时,平衡后A的质量分数小于w% |
(1)Z元素在周期表中的位置是
(2)Y2ZX3溶液显
a.滴入酚酞溶液变红,再加入稀H2SO4红色退去
b.滴入酚酞溶液变红,再加入氯水红色退去
c.滴入酚酞溶液变红,再加入BaCl2溶液产生沉淀且红色退去
(3)化合物Cu2X和Cu2Z可发生如下转化(其中D是纤维素水解的最终产物):Cu2Z
| 浓硝酸 |
| 一定量NaOH |
| D的溶液 |
①D的化学式是
②Cu2X与浓硝酸反应有红棕色气体生成,则化学反应方程式是
(4)某温度下,在一个5L的密闭容器中充入0.2mol ZX2和0.1mol X2,20s后达到平衡,测得容器中含有0.18mol ZX3,则用X2表示该反应的平均速率是v(X2)=
(15分)2009年12月7日~18日在丹麦首都哥本哈根召开的联合国气候会议,就未来应对气候变化的全球行动签署新的协议。而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)
随时间变化如图所示:

①从反应开始到平衡,氢气的平均反应速 (H2)=_______。
(H2)=_______。
②下列措施中一定不能使 (CH3OH)/ (CO2)增大的是_______。
A.降低温度 B.缩小容器的容积
C.将水蒸气从体系中分离 D.使用更有效的催化剂
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的电离平衡常数K=________。(已知:10-5.6=2.5×10-6)。
HCO3-+H+的电离平衡常数K=________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将1.12L CO2通入100mL 1mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序为________;
(4)如图是乙醇燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处的通入的是_____(填“乙醇”或“氧气”),b处电极上发生的电极反应是________。
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_________。
查看习题详情和答案>>