网址:http://m.1010jiajiao.com/timu3_id_345521[举报]
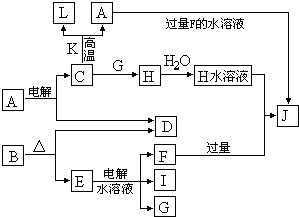
请填空:
(1)D与I能形成原子个数比为1:1的共价化合物,请写出其分子式:
G与I也能形成原子个数比为1:1的共价化合物,请写出其电子式:
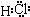
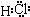
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解1L1mol?L-1的E水溶液的化学方程式:
| ||
| ||
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%.反应C→L的化学方程式是
| ||
| ||
(4)写出A+F→J的离子方程式:
| A、反应后的固体混合物中还含有碳 | B、反应后的固体混合物总质量为13.6g | C、反应后的固体混合物中氧化物的物质的量为0.05mol | D、反应后的固体混合物中单质Cu的质量为12.8g |
A.原子序数为6,核外有13个电子?
B.核内有6个质子,核外有7个电子?
C.质量数为13,原子序数为6,核内有7个质子?
D.质量数为13,原子序数为6,核内有7个中子
查看习题详情和答案>>![]() C—NMR(核磁共振)可以用于含碳化合物的结构分析。
C—NMR(核磁共振)可以用于含碳化合物的结构分析。![]() C表示的碳原子
C表示的碳原子
A.核外有13个电子,其中6个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
查看习题详情和答案>>(13分)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
| n(SO₃²﹣):n(HSO₃﹣) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
查看习题详情和答案>>