网址:http://m.1010jiajiao.com/timu3_id_345459[举报]
某研究性学习小组做实验时偶然发现,表面擦去氧化膜的镁片可与NaHCO3溶液反应产生大量气体和白色不溶物。该小组同学通过如下实验,验证产物并探究反应原理。
实验①:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞试液的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
Ⅰ、定性实验
(1)气体的检验
实验②:将实验①中收集到的气体点燃,发现气体安静燃烧,火焰呈淡蓝色。则气体为?????????? 。
(2)该小组同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为 ??
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[yMg(OH)2?xMgCO3]
请设计一个实验检验固体中是否含有MgCO3,写出实验操作、现象和结论:??????????????????????????????????????????????????????????????????????????????????? 。
(3)实验③:取实验①中的滤液,向其中加入少量CaCl2稀溶液,产生白色沉淀,溶液红色变浅,说明溶液中存在CO32-离子。
Ⅱ、定量实验
(4)为进一步确定实验I的白色不溶物的成分,进行以下定实验,装置如图所示:

称取干燥、纯净的白色不溶物 7.36 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.72g,装置B增重2.64 g。白色不溶物的化学式为???????????????? 。
(5)写出镁与饱和碳酸氢钠溶液反应的化学方程式??????????????????????????? 。
Ⅲ、反应原理分析
(6)NaHCO3溶液中存在如下电离平衡:H2O H+ + OH-、HCO3-
H+ + OH-、HCO3- H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因:????????????????????????????????????? 。
H+ +CO32-,请从平衡移动角度分析实验①产生大量气体和白色不溶物的原因:????????????????????????????????????? 。
查看习题详情和答案>>
某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)该研究小组是否成功制得 +1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
(2)甲与水反应可得H2,其化学方程式是 。反应所得溶液经结晶后,可得到一种晶体,其化学式为CaCl2· xCa(OH)2· 12H2O。为确定x的值,请设计实验方案 。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料) 。
查看习题详情和答案>>
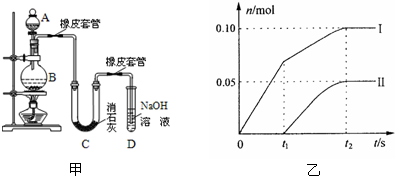
(1)A仪器的名称是
(2)漂白粉将在U型管中产生,其化学反应方程式是
(3)有同学建议在两个橡皮套管内的玻璃管口应尽量紧靠,原因是
(4)此实验结果所得Ca(ClO)2产率太低.经分析并查阅资料发现主要原因是在U型管中存在两个副反应:1度较高时氯气与消石灰反应生成了Ca(ClO3)2,为避免此副反应的发生,可采取的措施是
a、图中曲线I表示
b、所取石灰乳中含有Ca(OH)2的物质的量为
c、另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=
②试判断另一个副反应是(写出此反应方程式)