网址:http://m.1010jiajiao.com/timu3_id_345281[举报]
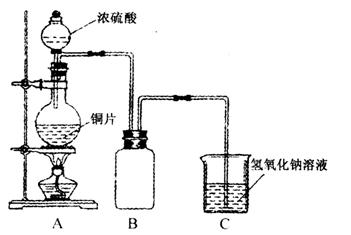
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示的装置先进行了有关实验:

⑴B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整。
⑵实验中他们取6.4g铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜与浓硫酸反应的化学方程式
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是 。
③下列试剂中能够证明反应结束后的烧瓶中确有余酸的是 (填写字母编号)
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为了测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
①甲同学设计方案是:先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有很多种,请问下列实验方案中不可行的是 (填写字母编号)
A:将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B:将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称量沉淀
C:用排水法测定装置A产生气体的体积(已折算成标准状况)
D:将装置A产生的气体缓缓通入足量的氢氧化钡溶液(预先除去了溶解O2),反应完全后,过滤、洗涤、干燥,称量沉淀(隔绝空气条件下)
②乙同学设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL于锥形瓶中,滴加2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测定出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液体积不变,你认为乙同学设计的实验方案能否求得余酸的物质的量浓度 ,(填能或否),其理由是 。
(4)请你再设计一个可行的实验方案来测定余酸的物质的量浓度。简要写出操作步骤及需要测定的数据,并写出相应的计算式。
查看习题详情和答案>>(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请把导管补充完整。(在原图中画即可)
(2)实验中他们取6.4 g铜片和12 mL18 mol·1-1浓硫酸放在圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:_________________________________________。
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是:____________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:_________________(填写字母编号)。
A.铁粉 B.BaCl2溶液
C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:①甲学生设计的方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是______________________(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量的用稀硫酸酸化的KMnO4溶液,再加入足量的BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况下)
D.将装置A产生的气体缓缓通入足量的氢氧化钡溶液中,反应完全后,过滤、洗涤、干燥,称最沉淀
②乙学生没计的方案是:向反应后的溶液中加蒸馏水稀释至1000 mL,取20 mL于锥形瓶中,滴入2—3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的pH约为5),通过测出消耗NaOH溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生没计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“否”),其理由是_______。
(4)请再设计一个可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)________________________________________________________。
查看习题详情和答案>>夜幕降临,北京奥运会主会场“鸟巢”内灯火辉煌,鼓瑟齐鸣。璀璨的烟花在空中组成奥运五环等图案,与场内表演相呼应。鸟巢夜景照明由五个部分组成,其中主体照明以传统文化元素“中国红”为主色。下图是北京鸟巢试放烟火奥运五环图,并回答下列问题:w.w.w.k.s.5.u.c.o.m

(1)火焰利用了部分金属的元素特征的 反应,该反应属于 (填“物理”或“化学”变化。)
(2)现在有一种火焰的引发是当浓H2SO4滴下去跟氯酸钾起作用时,便生成了奇臭的二氧化氯气体且发现只有氯元素的化合价发生变化。请写出该反应的方程式
(3)下图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为![]() ,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:

①B的水溶液呈弱酸性,其主要的电离方程式可表示为__________________,D的化学式是_________。
②A、B、E中均含有的一种元素符号为______________。
③C与纯碱反应的化学方程式为____________________。
④液态B与液态E反应可生成一种单质和一种常见液体,1molB参加反应放出热量QkJ,其反应的热化学方程式为_______________________。
查看习题详情和答案>>某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4g 铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:____________________________________;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是________;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:________(填写编号)。
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲、乙学生进行了如下设计:
①甲同学设计方案是:先测定铜与浓硫酸反应产生的SO2的量,在计算余酸的物质的量浓度。他认为测定二氧化硫的量的方法有多种,请问下列实验方案中可行的是_______(填写编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案进行分析(可以不填满):
| 方案序号 | 分析 | 误差(偏低或偏高) | 改变措施 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“不能”),其理由是_________________________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)_____________________________。
查看习题详情和答案>>
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4g 铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:____________________________________;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是________;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:________(填写编号)。
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲、乙学生进行了如下设计:
①甲同学设计方案是:先测定铜与浓硫酸反应产生的SO2的量,在计算余酸的物质的量浓度。他认为测定二氧化硫的量的方法有多种,请问下列实验方案中可行的是_______(填写编号)。
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案进行分析(可以不填满):
|
方案序号 |
分析 |
误差(偏低或偏高) |
改变措施 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“不能”),其理由是_________________________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)_____________________________。
查看习题详情和答案>>